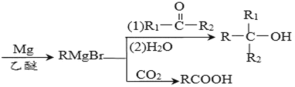
题目内容
【题目】科学工作者研发了一种 SUNCAT 的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法不正确的是
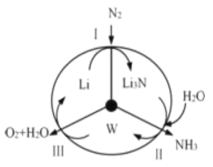
A.过程Ⅰ得到的 Li3N 中 N 元素为3 价
B.过程Ⅱ生成 W 的反应:Li3N+3H2O═3LiOH+NH3↑
C.过程Ⅲ中能量转化的形式:电能转变为化学能
D.过程Ⅲ涉及到反应:2H2O-4 e═O2↑+4H+
【答案】D
【解析】
A.由图可知,过程Ⅰ是Li和N2生成Li3N,Li元素为+1价,N 元素为3 价,A正确;
B.W是LiOH,过程II的反应为:Li3N+3H2O=3LiOH+NH3![]() ,B正确;
,B正确;
C.过程Ⅲ是4LiOH=4Li+2H2O+O2↑,该反应需要电解,所以是电能转变为化学能,C正确;
D.由于该过程为了合成NH3,故电解质环境为碱性,过程Ⅲ涉及到反应为:4OH--4e-=O2![]() +2H2O,D错误;
+2H2O,D错误;
故选D。

【题目】经最新研究发现,NOx和SOx是形成雾霾天气的主要原因之一,因此研究NOx、SOx等大气污染物的妥善处理具有重要意义。
(1)为了消除NO造成的污染,通常采用一氧化碳和氢气进行催化还原NO。
已知:①N2(g)+O2(g)=2NO(g) ΔH=akJmol-1;
②2H2(g)+O2(g)=2H2O(l) ΔH=bkJmol-1;
③H2O(g)=H2O(l) ΔH=ckJmol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:________________________。
(2)目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:
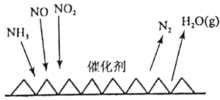
当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生反应。当有12mol电子发生转移时,则参与反应的NO2的物质的量为________。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/ | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①从0~2s该反应的平均速率v(NO2)=________mol/(Ls)。
②T1温度时,上述反应的化学平衡常数K=________。
③若将容器的温度改变为T2时其k正=k逆,则T1________T2(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
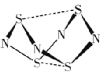
(4)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。
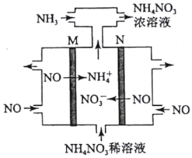
①N极的电极反应式为________________________。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________。