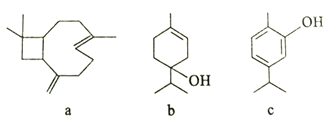
题目内容
【题目】 N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g),则下列说法正确的是

A.Ⅰ中破坏的均为极性键
B.Ⅳ中NH2与H2生成NH3
C.Ⅱ、Ⅲ、Ⅳ均为放热过程
D.N2(g)+3H2(g)![]() 2NH3(g)1mol氮气完全反应放热44kJ
2NH3(g)1mol氮气完全反应放热44kJ
【答案】C
【解析】
A.氮气和氢气中只含非极性共价键,则I中破坏只有非极性键,故A错误;
B.Ⅲ结合生成NH2,可知Ⅳ中NH2与H生成NH3,故B错误;
C.Ⅱ、Ⅲ、Ⅳ均为成键过程,形成化学键释放能量,则均为放热过程,故C正确;
D.由图可知,0.5molN2反应生成NH3,![]() =1129(324+389+460)=44 kJ/mol,则N2(g)+3H2(g) 2NH3(g)
=1129(324+389+460)=44 kJ/mol,则N2(g)+3H2(g) 2NH3(g) ![]() =88kJ/mol,故D错误;
=88kJ/mol,故D错误;![]()
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目