题目内容
【题目】下列说法正确的是
A.键角:BF3>CH4>H2O>NH3
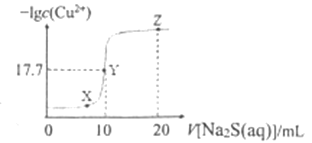
B.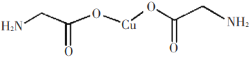 中σ键和π键比例为7:1
中σ键和π键比例为7:1
C.已知二茂铁(Fe(C5H5)2)熔点是173![]() (在100
(在100![]() 时开始升华),沸点是249
时开始升华),沸点是249![]() ,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,
,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,![]() 与Fe2+之间是以离子键相结合
与Fe2+之间是以离子键相结合
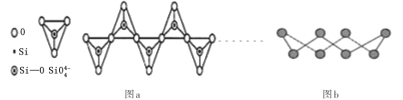
D.在硅酸盐中,![]() 四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
【答案】D
【解析】
A.BF3为平面三角,键角为120![]() ,CH4为正四面体,其键角为109°28’,NH3为三棱锥型,键角为107
,CH4为正四面体,其键角为109°28’,NH3为三棱锥型,键角为107![]() ,H2O为V型,其键角为104
,H2O为V型,其键角为104![]() ,所以键角:BF3>CH4>NH3>H2O,故A错误;
,所以键角:BF3>CH4>NH3>H2O,故A错误;
B.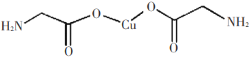 中σ键和π键数目为18和2,所以σ键和π键数比例为9:1,故B错误;
中σ键和π键数目为18和2,所以σ键和π键数比例为9:1,故B错误;
C.C5H5-与Fe2+之间形成的化学键时,亚铁离子提供空轨道, C提供孤对电子,二者形成配位键,故C错误;
D.硅酸盐中的硅酸根( SiO4-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;S8单质中S原子有两个孤电子对和两个共价键,杂化方式为sp3,故D正确;
故答案:D。

【题目】烯烃是重要的有机化工原料。实验室主要用浓硫酸或浓磷酸作催化剂使醇脱水制取烯烃。某同学使用环己醇脱水制备环己烯。设计方案如下:
(一)主要仪器和试剂
仪器:50mL圆底烧瓶、分馏柱、直形冷凝管、10mL量筒、分液漏斗、100mL锥形瓶、蒸馏头、接液管。
试剂:10.0g(10.4mL,0.1mol)环己醇、5mL浓磷酸、氯化钠、无水氯化钙、5%碳酸钠水溶液。
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
化学物质 | 相对分子 质量 | 相对密度/ g·cm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.96 | 161.1 | 稍溶于水 |
磷酸(85%) | 98 | 1.83 | 213 | 易溶于水 |
环己烯 | 82 | 0.89 | 83.3 | 微溶于水 |
(三)实验流程

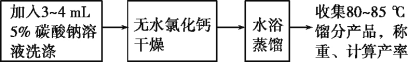
请回答:
(1)加热过程中,若忘记加沸石,应如何操作?___
(2)将粗产品分去水层所需要用到的主要实验仪器是___。
(3)本实验用浓磷酸代替浓硫酸的优点:___。
(4)该实验的主要副产物为___(填物质名称)。
(5)在提纯环己烯时,用等体积的饱和食盐水,而不用水的原因是___。加入3~4mL5%碳酸钠溶液的目的是___。
(6)水浴蒸馏最后得到7.0g产品,则反应的产率为___(保留2位有效数字)。
【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池和液晶显示器制造中得到广泛应用。![]() 是一种三角锥型分子,键角
是一种三角锥型分子,键角![]() ,沸点
,沸点![]() ;可在铜的催化作用下由
;可在铜的催化作用下由![]() 和过量
和过量![]() 反应得到:
反应得到: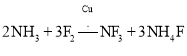
![]() 上述化学方程式中的5种物质所含的化学键类型有 ______
上述化学方程式中的5种物质所含的化学键类型有 ______ ![]() 填序号
填序号![]() 。
。
![]() 离子键
离子键![]() 共价键
共价键![]() 配位键
配位键![]() 金属键
金属键
![]() 与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
![]() 的沸点比
的沸点比![]() 的沸点
的沸点![]() 低得多的主要原因是 ______ 。
低得多的主要原因是 ______ 。
![]() 理论上HF、
理论上HF、![]() 和NaCl按6:1:2的物质的量之比恰好反应生成HCl、
和NaCl按6:1:2的物质的量之比恰好反应生成HCl、![]() 和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
![]() 根据下列五种元素的第一至第四电离能数据
根据下列五种元素的第一至第四电离能数据![]() 单位:
单位:![]()
![]() ,回答下面各题:
,回答下面各题:
元素代号 |
|
|
|
|
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 ______ 和 ______ 。
②T元素最可能是 ______ (填“s”、“p”、“d”、“ds”等)区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ______ ,其中心原子的杂化轨道类型为 ______ 。