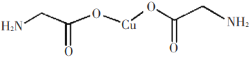
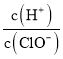题目内容
【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池和液晶显示器制造中得到广泛应用。![]() 是一种三角锥型分子,键角
是一种三角锥型分子,键角![]() ,沸点
,沸点![]() ;可在铜的催化作用下由
;可在铜的催化作用下由![]() 和过量
和过量![]() 反应得到:
反应得到: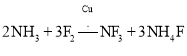
![]() 上述化学方程式中的5种物质所含的化学键类型有 ______
上述化学方程式中的5种物质所含的化学键类型有 ______ ![]() 填序号
填序号![]() 。
。
![]() 离子键
离子键![]() 共价键
共价键![]() 配位键
配位键![]() 金属键
金属键
![]() 与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为 ______ 。
![]() 的沸点比
的沸点比![]() 的沸点
的沸点![]() 低得多的主要原因是 ______ 。
低得多的主要原因是 ______ 。
![]() 理论上HF、
理论上HF、![]() 和NaCl按6:1:2的物质的量之比恰好反应生成HCl、
和NaCl按6:1:2的物质的量之比恰好反应生成HCl、![]() 和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是 ______ ,配位数为 ______ 。
![]() 根据下列五种元素的第一至第四电离能数据
根据下列五种元素的第一至第四电离能数据![]() 单位:
单位:![]()
![]() ,回答下面各题:
,回答下面各题:
元素代号 |
|
|
|
|
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 ______ 和 ______ 。
②T元素最可能是 ______ (填“s”、“p”、“d”、“ds”等)区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ______ ,其中心原子的杂化轨道类型为 ______ 。
【答案】abcd ![]()
![]() 能形成氢键,
能形成氢键,![]() 只有范德华力
只有范德华力 ![]() 6 R U p 平面三角形
6 R U p 平面三角形 ![]()
【解析】
![]() 中含有离子键、共价键和配位键,Cu含有金属键;
中含有离子键、共价键和配位键,Cu含有金属键;
![]() 与铜属于同一周期,则为第四周期,未成对价电子数最多的元素,该元素的3d能级上有5个电子、4s能级上有1个电子时,其未成对电子数最多,所以该元素是24号元素Cr元素,根据构造原理书写其基态原子核外电子排布式;
与铜属于同一周期,则为第四周期,未成对价电子数最多的元素,该元素的3d能级上有5个电子、4s能级上有1个电子时,其未成对电子数最多,所以该元素是24号元素Cr元素,根据构造原理书写其基态原子核外电子排布式;
![]() 分子间氢键的存在导致分子晶体的熔沸点升高;
分子间氢键的存在导致分子晶体的熔沸点升高;
![]() 根据题意可写出反应的化学方程式:6HF+NaAlO2+NaCl=2HCl+2H2O+Na3AlF6,
根据题意可写出反应的化学方程式:6HF+NaAlO2+NaCl=2HCl+2H2O+Na3AlF6,![]() 中心离子为
中心离子为![]() ,配位数为6;
,配位数为6;
![]() 由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现
由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现![]() 价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现
价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现![]() 价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现
价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现![]() 价,最外层电子数为3;
价,最外层电子数为3;
![]() 根据原子最后填入的电子名称确定该元素所属区域;根据价层电子对互斥理论确定微粒构型、原子杂化方式。
根据原子最后填入的电子名称确定该元素所属区域;根据价层电子对互斥理论确定微粒构型、原子杂化方式。
![]() 中含有离子键、共价键和配位键,Cu属于金属单质含有金属键,NH3、NF3、F2中含共价键;故答案为:abcd;
中含有离子键、共价键和配位键,Cu属于金属单质含有金属键,NH3、NF3、F2中含共价键;故答案为:abcd;
![]() 与铜属于同一周期,则为第四周期,未成对价电子数最多的元素,该元素的3d能级上有5个电子、4s能级上有1个电子时,其未成对电子数最多,所以该元素是24号元素Cr元素,根据构造原理知,其基态原子核外电子排布式为
与铜属于同一周期,则为第四周期,未成对价电子数最多的元素,该元素的3d能级上有5个电子、4s能级上有1个电子时,其未成对电子数最多,所以该元素是24号元素Cr元素,根据构造原理知,其基态原子核外电子排布式为![]() 或
或![]() ,则其价电子排布式为
,则其价电子排布式为![]() ;故答案为:
;故答案为:![]() ;
;
![]() 分子间能形成氢键,
分子间能形成氢键,![]() 只有范德华力,分子间氢键的存在导致分子晶体的熔沸点升高,所以
只有范德华力,分子间氢键的存在导致分子晶体的熔沸点升高,所以![]() 的沸点比
的沸点比![]() 的沸点
的沸点![]() 低得多,故答案为:
低得多,故答案为:![]() 能形成氢键,
能形成氢键,![]() 只有范德华力;
只有范德华力;
![]() 由题意可知该反应的化学方程式应为:6HF+NaAlO2+NaCl=2HCl+2H2O+Na3AlF6,该微溶物为:
由题意可知该反应的化学方程式应为:6HF+NaAlO2+NaCl=2HCl+2H2O+Na3AlF6,该微溶物为:![]() ,中心离子为Al或
,中心离子为Al或![]() ,配位数为6,故答案为:
,配位数为6,故答案为:![]() ;6;
;6;
![]() 由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现
由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现![]() 价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现
价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现![]() 价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现
价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现![]() 价,最外层电子数为3,R和U的第一电离能较小,第二电离能剧增,故表现
价,最外层电子数为3,R和U的第一电离能较小,第二电离能剧增,故表现![]() 价,最外层电子数为1,二者位于同一族,故答案为:R;U;
价,最外层电子数为1,二者位于同一族,故答案为:R;U;
![]() 的第一、第二、第三电离能较小,第四电离能剧增,表现
的第一、第二、第三电离能较小,第四电离能剧增,表现![]() 价,最外层电子数为3,可能为第IIIA族元素,其最后填入的电子是p电子,最可能是p区元素;若T为第二周期元素,则T是B元素,F是第三周期元素中原子半径最小的元素,则F是Cl元素,T、F二者形成的化合物是
价,最外层电子数为3,可能为第IIIA族元素,其最后填入的电子是p电子,最可能是p区元素;若T为第二周期元素,则T是B元素,F是第三周期元素中原子半径最小的元素,则F是Cl元素,T、F二者形成的化合物是![]() ,
,![]() 中B原子价层电子对数
中B原子价层电子对数![]() 且不含孤电子对,所以
且不含孤电子对,所以![]() 为平面正三角形,B原子采用
为平面正三角形,B原子采用![]() 杂化,故答案为:p;平面三角形;
杂化,故答案为:p;平面三角形;![]() 。
。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
![]() 尿素
尿素![]() 与氰酸铵
与氰酸铵![]() 互为 ______ ;氰酸铵属于 ______ 化合物
互为 ______ ;氰酸铵属于 ______ 化合物![]() 选填:“离子”或“共价”
选填:“离子”或“共价”![]() 。
。
![]() 液氨是一种贮氢材料,气态氨转变为液氨将 ______ 能量
液氨是一种贮氢材料,气态氨转变为液氨将 ______ 能量![]() 选填:“吸收”或“释放”
选填:“吸收”或“释放”![]() 液氨可通过图1装置释放氢气,该过程中能量转化方式为 ______ 。
液氨可通过图1装置释放氢气,该过程中能量转化方式为 ______ 。
![]() 氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和
氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]() 。
。
①能说明该反应已达到平衡状态的标志是 ______ ![]() 不定项选择
不定项选择![]() 。
。
![]() 反应速率
反应速率![]()
![]()
![]()
![]() 容器内压强不再随时间而发生变化
容器内压强不再随时间而发生变化
![]() 容器内
容器内![]() 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化
![]() 容器内
容器内![]() :
:![]() :
:![]() :
:![]() :4:5:6
:4:5:6
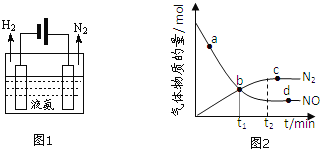
②某次实验中测得容器内NO及![]() 的物质的量随时间变化如图2所示,图中
的物质的量随时间变化如图2所示,图中![]() 正
正![]() 与
与![]() 逆
逆![]() 相等的点为 ______
相等的点为 ______ ![]() 选填字母
选填字母![]() 。
。
![]() 已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
共价键 |
|
|
|
能量变化 | 436 |
| 946 |
则合成氨反应:![]()
![]() ______
______ ![]()
![]() 工业上用氨水吸收硫酸工业尾气中的
工业上用氨水吸收硫酸工业尾气中的![]() ,既可消除污染又可获得
,既可消除污染又可获得![]() 等产品.若用1000kg 含
等产品.若用1000kg 含![]() 质量分数为
质量分数为![]() 的氨水吸收
的氨水吸收![]() 且全部转化为
且全部转化为![]() ,不考虑其它成本,则可获得的利润为 ______ 元
,不考虑其它成本,则可获得的利润为 ______ 元![]() 参照下面的价格表
参照下面的价格表![]() 。
。
| 无水 | |
价格 |
|
|