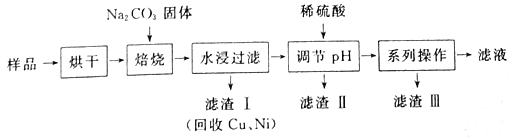
题目内容
【题目】下图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
硫酸
分子式:H2SO4
相对分子质量:98
密度:1.84g/mL
H2SO4的质量分数:98%
(1)该浓硫酸中H2SO4的物质的量浓度为_________。
(2)某学生欲用上述浓硫酸和蒸馏水配制100mL物质的量浓度为0.8 mol·L-1的稀硫酸,该学生需要量取_________mL上述浓硫酸进行配制。
(3)为配制(2)中的稀硫酸,除了量筒、烧杯、胶头滴管外,还缺少的玻璃仪器是_________。
(4)在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是_________(填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.容量瓶未干燥即用来配制溶液
e.往容量瓶转移时,有少量液体溅出;
f.未洗涤稀释浓硫酸的烧杯;
【答案】 18.4 mol·L-1 4.3 玻璃棒、100mL容量瓶 ac
【解析】试题分析:本题考查物质的量浓度与溶质质量分数的换算,配制物质的量浓度的溶液和误差分析。
(1)c=![]() =
=![]() =18.4mol/L。
=18.4mol/L。
(2)c(浓硫酸)V(浓硫酸)=c(稀硫酸)V(稀硫酸),V(浓硫酸)=![]() =4.3mL。
=4.3mL。
(3)由浓硫酸配制稀硫酸需要的仪器有:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,还需要玻璃棒、100mL容量瓶。
(4)根据公式cB=![]() 分析。a项,定容时俯视观察,溶液体积偏小,所配溶液浓度偏高;b项,定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水,溶液体积偏大,所配溶液浓度偏低;c项,浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移,浓硫酸溶于水放热,冷却后溶液体积偏小,所配溶液浓度偏高;d项,容量瓶未干燥即用来配制溶液,对实验结果无影响;e项,往容量瓶转移时,有少量液体溅出,溶质物质的量偏小,所配溶液浓度偏低;f项,未洗涤稀释浓硫酸的烧杯,溶质物质的量偏小,所配溶液浓度偏低;答案选ac。
分析。a项,定容时俯视观察,溶液体积偏小,所配溶液浓度偏高;b项,定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水,溶液体积偏大,所配溶液浓度偏低;c项,浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移,浓硫酸溶于水放热,冷却后溶液体积偏小,所配溶液浓度偏高;d项,容量瓶未干燥即用来配制溶液,对实验结果无影响;e项,往容量瓶转移时,有少量液体溅出,溶质物质的量偏小,所配溶液浓度偏低;f项,未洗涤稀释浓硫酸的烧杯,溶质物质的量偏小,所配溶液浓度偏低;答案选ac。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案