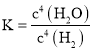题目内容
【题目】![]() 化学反应原理
化学反应原理![]() 从不同的视角对化学反应进行了探究分析,以下观点正确的是
从不同的视角对化学反应进行了探究分析,以下观点正确的是![]()
![]()
A.化学反应的反应热与反应的途径有关
B.电解过程中,化学能转化为电能而“储存”起来
C.强电解质溶液的导电能力一定强于弱电解质溶液
D.化学平衡常数的表达式与化学反应方程式的书写有关
【答案】D
【解析】
A. 根据盖斯定律可知,化学反应的反应热与反应的始态和终态有关,而与反应途径无关,故A错误;
B. 电解过程中,在电流作用下发生电化学反应,所以电能转化为化学能,故B错误;
C. 溶液的导电性与离子浓度有关,强电解质的浓度很小时,其溶液的导电性很弱,如硫酸钡是强电解质,其溶液的浓度很小,导电性很弱,故强电解质溶液的导电能力不一定强于弱电解质溶液,C错误;
D. 化学平衡常数等于生成物浓度的幂之积与反应物浓度的幂之积的比值,故其与化学反应方程式的书写有关,D正确。
故选:D。

练习册系列答案
相关题目
【题目】已知:![]()
![]() 。在
。在![]() 的密闭容器中进行模拟合成实验,将
的密闭容器中进行模拟合成实验,将![]() 和
和![]() 通入容器中,分别在
通入容器中,分别在![]() 和
和![]() 反应,每隔一段时间测得容器中的甲醇的浓度如下:
反应,每隔一段时间测得容器中的甲醇的浓度如下:
| 10 | 20 | 30 | 40 | 50 | 60 |
300 | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
下列说法正确的是 ![]()
![]()
A.![]() 时,开始
时,开始![]() 内
内![]() 的平均反应速率
的平均反应速率![]()
B.反应达到平衡时,两温度下CO和![]() 的转化率之比均为
的转化率之比均为![]()
C.![]() 反应达到平衡时,放出的热量为
反应达到平衡时,放出的热量为![]()
D.![]() 时,若容器的容积压缩到原来的
时,若容器的容积压缩到原来的![]() ,则
,则![]() 增大,
增大,![]() 减小
减小