题目内容
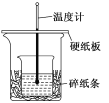
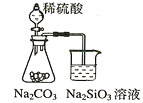
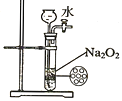
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是

A. 图甲中(1)、(2)两个实验中H2O2分解的△H相同
B. 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率
C. 图甲实验可通过观察产生气泡的快慢来比较反应速率
D. 图乙中,测定反应速率的装置可将分液漏斗用长颈漏斗替代 ,其测定结果相同
【答案】D
【解析】
A. 催化剂只降低反应的活化能,改变反应路径,不改变反应的反应热;
B.为比较Fe3+和Cu2+对H2O2分解的催化效果,可以在相同条件下,通过收集相同气体体积所需的时间或相同时间收集气体的体积来比较反应速率;
C. 据反应剧烈程度和反应现象的关系判断;
D. 产生的气体从长颈漏斗逸出,不能测定气体的体积。
A. 催化剂只降低反应的活化能,改变反应路径,不改变反应的反应热,所以(1)、(2)两个实验中H2O2分解的△H相同,所以A选项是正确的;
B. 为比较Fe3+和Cu2+对H2O2分解的催化效果,可以在相同条件下,通过收集相同气体体积所需的时间或相同时间收集气体的体积来比较反应速率,所以B选项是正确的;
C. 反应速率可以通过观察产生气泡的快慢来判断,所以C选项是正确的;
D. 产生的气体从长颈漏斗逸出,不能测定气体的体积,应利用分液漏斗或长颈漏斗下端进入液面下,所以D选项是错误的。
故答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。

已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
(l)“还原酸浸”时氧化产物为CO2,发生反应的化学方程式为____。
(2)“还原酸浸”实验中,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为 ____ 。

(3)滤液l中的阳离子组成见下表:
组成 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
浓度/(mol·L-1) | 0.85 | 2.4×10-3 | 1.0×10-2 | 2.0×10-3 |
“除杂”时先加MnO2,MnO2的作用为 ___。
再加氨水调节pH使杂质离子沉淀完全,通过计算说明Al3+沉淀完全时Mn2+是否开始沉淀 ___。
(4)“沉锰”时发生反应的离子方程式为 ___。
(5)“沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴人NH4HCO3,溶液中,或反应终点pH>7可能造成同样的后果,该后果是____;如粜反应终点pH<7,可能的后果是______。
(6)从滤液2中回收得到的副产品的用途为________。