题目内容
【题目】(2017·武汉市高中毕业生五月模拟考试)草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::
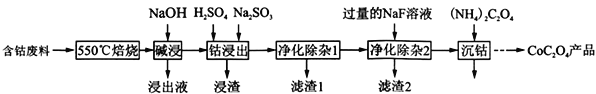
(1) “550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3) “钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是___________________________(用离子方程式表示);再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是_____________________。
(5) “净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l05mol /L,则滤液中 c(Mg2+)为______________ [已知Ksp(MgF2) =7.35×1011、Ksp(CaF2) =1.05×1010]。
(6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
【答案】除去碳和有机物 NaAlO2(答“NaAlO2和NaOH”也可) 2Co3++SO32+H2O![]() 2Co2++SO42+2H+ 2Fe2++2H++H2O2
2Co2++SO42+2H+ 2Fe2++2H++H2O2![]() 2Fe3++2H2O Fe(OH) 3 7.0×106 mol/L 95.55%
2Fe3++2H2O Fe(OH) 3 7.0×106 mol/L 95.55%
【解析】
(1)含钴废料中的碳及有机物在550℃焙烧时可以生成二氧化碳等被除去,故答案为除去碳和有机物;
(2)含钴废料中的Al2O3能够被氢氧化钠溶解,因此浸出液中主要含有偏铝酸钠,故答案为NaAlO2;
(3)“钴浸出”过程中Co3+可以被亚硫酸钠还原为Co2+,反应的离子方程式为2Co3++SO32+H2O![]() 2Co2++SO42+2H+,故答案为2Co3++SO32+H2O
2Co2++SO42+2H+,故答案为2Co3++SO32+H2O![]() 2Co2++SO42+2H+;
2Co2++SO42+2H+;
(4)在钴浸出过程中铁离子被亚硫酸钠含有为亚铁离子,在“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,可以将亚铁离子氧化为铁离子,离子方程式为2Fe2++2H++H2O2![]() 2Fe3++2H2O ;再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,使铁离子沉淀为氢氧化铁,故答案为2Fe2++2H++H2O2
2Fe3++2H2O ;再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,使铁离子沉淀为氢氧化铁,故答案为2Fe2++2H++H2O2![]() 2Fe3++2H2O;Fe(OH) 3;
2Fe3++2H2O;Fe(OH) 3;
(5)根据Ksp(CaF2) =1.05×1010,若所得滤液中c(Ca2+)=1.0×l05mol /L,则c(F)=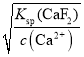 =
=![]()
![]() mol /L,则c(Mg2+)=
mol /L,则c(Mg2+)=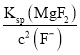
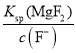 =
=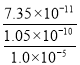
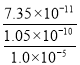 =7.0×106 mol/L,故答案为7.0×106 mol/L;
=7.0×106 mol/L,故答案为7.0×106 mol/L;
(6)设草酸钴的质量为x,根据方程式:5H2C2O4+2MnO4+6H+![]() 2Mn2++10CO2↑+8H2O,草酸根守恒可得:
2Mn2++10CO2↑+8H2O,草酸根守恒可得:
5CoC2O4~5(NH4)2C2O4~5H2C2O4~2MnO4
5×147 g 2 mol
x 0.026 L×0.1000 mol/L
![]() =
=![]() ,解得x=0.9555 g,样品纯度= 95.55%,故答案为95.55%。
,解得x=0.9555 g,样品纯度= 95.55%,故答案为95.55%。

 阅读快车系列答案
阅读快车系列答案【题目】下列“实际应用”对应“化学知识原理”说法错误的是( )
选项 | 实际应用 | 化学知识原理 |
A | 泡沫灭火器中装有碳酸氢钠溶液 和硫酸铝溶液 | 碳酸氢钠溶液和硫酸铝溶液水解且相互促进 |
B | 工业上采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
D | 选用金属锂做电池电极材料 | 锂轻且在空气中稳定 |
A. AB. BC. CD. D