题目内容
【题目】过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ.二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是__。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
Ⅱ.2007年诺贝尔物理学奖为法国科学家阿尔贝费尔和德国科学家彼得格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。

(1)用A、B、O表示这类特殊晶体的化学式:__。
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:__(用含x的代数式表示)。
(3)Mn的核外电子排布式为:___。
(4)下列有关说法正确的是___。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2:

【答案】ABCD ABO3 ![]() 1s22s22p63s23p63d54s2 AC
1s22s22p63s23p63d54s2 AC
【解析】
Ⅱ、(1)由分摊法计算可得;
(2)由化合价代数和为零和锰原子个数守恒列关系式计算可得;
(3)Mn的原子序数为27,由4个电子层,最外层有2个电子;
(4)A.由金属在周期表中的位置可知;
B. N元素原子2p能级是半满稳定状态,能量较低;
C.元素的电负性越强,金属性越弱;
D.图中堆积方式为镁型。
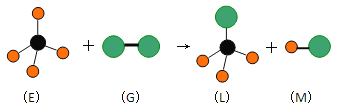
Ⅰ、![]() 苯与
苯与![]() 价电子总数相等,原子数也相等互为等电子体,故A正确;
价电子总数相等,原子数也相等互为等电子体,故A正确;
B.甲醛、苯分子中碳原子均含有3个![]() 键,没有孤对电子,采用
键,没有孤对电子,采用![]() 杂化,故B正确;
杂化,故B正确;
C. 苯、二氧化碳分子的空间结构对称,正电荷中心和负电荷中心重合,属于是非极性分子,水和甲醛分子的空间结构中,正电荷中心和负电荷中心不重合,属于极性分子,故C正确;
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键,故D正确;
ABCD正确,故答案为:ABCD;
Ⅱ、(1)由图1可知,晶胞中A位于顶点,晶胞中含有A为![]() 个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为
个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为![]() ,则化学式为
,则化学式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)设![]() 中三价锰与四价锰的物质的量分别为m和n,则有
中三价锰与四价锰的物质的量分别为m和n,则有 解之得
解之得![]() ,
,![]() ,则
,则![]() 中三价锰与四价锰的物质的量之比为
中三价锰与四价锰的物质的量之比为![]() ,故答案为:
,故答案为:![]() ;
;
(3)Mn的原子序数为27,核外电子排布为![]() ,故答案为:
,故答案为:![]() ;
;
(4)A.由金属在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,故A正确;
B.O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故B错误;
C.元素的电负性越强,金属性越弱,故C正确;
D.图中堆积方式为镁型,故D错误;
AC正确,故答案为:AC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案