题目内容
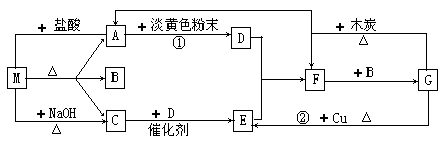
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出)。

(1)若A、D、E是短周期的非金属单质,且 A、D所含元素同主族,A、E含元素同周期,已知D单质在电子工业中有重要作用,则D的原子结构示意图为________;F的分子构型为________;反应①的化学方程式为__________________。
(2)若A、D为常见金属单质,且加热时A、D才能溶解在E的浓溶液中,写出反应③的化学方程式_ _________________;足量的A与B溶液充分反应后,生成物C中金属阳离子的检验方法为__________________;若以惰性电极电解B的水溶液,当阴极增重9.6g时,阳极生成气体在标准状况下的体积为________,写出电解B的水溶液的离子方程式__________________。

(1)若A、D、E是短周期的非金属单质,且 A、D所含元素同主族,A、E含元素同周期,已知D单质在电子工业中有重要作用,则D的原子结构示意图为________;F的分子构型为________;反应①的化学方程式为__________________。
(2)若A、D为常见金属单质,且加热时A、D才能溶解在E的浓溶液中,写出反应③的化学方程式_ _________________;足量的A与B溶液充分反应后,生成物C中金属阳离子的检验方法为__________________;若以惰性电极电解B的水溶液,当阴极增重9.6g时,阳极生成气体在标准状况下的体积为________,写出电解B的水溶液的离子方程式__________________。
(1)
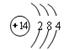 直线型 2C+SiO2
直线型 2C+SiO2 2CO↑+Si
2CO↑+Si(2)Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O 取少量C溶液于试管中,滴加KSCN溶液无明显颜色变化,再滴加氯水呈血红色 1.68 L
2Cu2+ + 2H2O
 2Cu + O2↑ + 4H+
2Cu + O2↑ + 4H+试题分析:(1)A、、E是短周期的非金属单质D在电子工业中有重要作用,则D为Si元素;由于 A、D所含元素同主族,所以A为C元素;能与C单质发生制取Si单质,则B为SiO2;反应的方程式为:C+ SiO2
 Si+2CO↑.C为CO气体;2CO+ O2
Si+2CO↑.C为CO气体;2CO+ O2 2CO2.故F为CO2。因为A、E含元素同周期,而且能与Si反应制取SiO2,则E为O元素;则D的原子结构示意图为;
2CO2.故F为CO2。因为A、E含元素同周期,而且能与Si反应制取SiO2,则E为O元素;则D的原子结构示意图为; CO2的分子是直线型分子,两个O原子在C原子的两侧,夹角为180º。反应①的化学方程式为C+ SiO2
CO2的分子是直线型分子,两个O原子在C原子的两侧,夹角为180º。反应①的化学方程式为C+ SiO2 Si+2CO↑。(2)若A、D为常见金属单质,且加热时A、D才能溶解在E的浓溶液中,根据金属的活动性顺序可知:A为Fe,D为Cu,E为浓H2SO4。B为CuSO4;反应③的化学方程式为Cu+2H2SO4(浓)
Si+2CO↑。(2)若A、D为常见金属单质,且加热时A、D才能溶解在E的浓溶液中,根据金属的活动性顺序可知:A为Fe,D为Cu,E为浓H2SO4。B为CuSO4;反应③的化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 。足量的Fe与CuSO4溶液发生反应产生C是FeSO4.F为Fe2(SO4)3.检验Fe2+离子的方法是取少量C溶液于试管中,滴加KSCN溶液无明显颜色变化,再滴加氯水呈血红色。若以惰性电极电解CuSO4的水溶液,电解的方程式为:CuSO4+2H2O
CuSO4+SO2↑+2H2O 。足量的Fe与CuSO4溶液发生反应产生C是FeSO4.F为Fe2(SO4)3.检验Fe2+离子的方法是取少量C溶液于试管中,滴加KSCN溶液无明显颜色变化,再滴加氯水呈血红色。若以惰性电极电解CuSO4的水溶液,电解的方程式为:CuSO4+2H2O  2Cu+2H2SO4+ O2↑。可见当阴极产生2mol的Cu时,阳极产生气体1mol。n(Cu)= 9.6g÷64g/mol=0.15mol,所以n(O2)="0.075mol," V(O2)= n·Vm=" 1.68L." 该反应的离子方程式为:2Cu2+ + 2H2O
2Cu+2H2SO4+ O2↑。可见当阴极产生2mol的Cu时,阳极产生气体1mol。n(Cu)= 9.6g÷64g/mol=0.15mol,所以n(O2)="0.075mol," V(O2)= n·Vm=" 1.68L." 该反应的离子方程式为:2Cu2+ + 2H2O  2Cu + O2↑ + 4H+。
2Cu + O2↑ + 4H+。
练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目

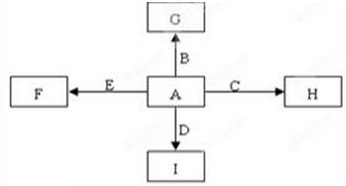
 B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接; 2F+D,F中E元素的质量分数为60%。回答问题:
2F+D,F中E元素的质量分数为60%。回答问题: