题目内容
【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ、在某一容积为5 L的体积不变的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
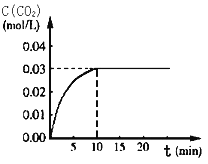
(1)根据图上数据,该温度(800℃)下的平衡常数K=________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有_____(填字母)
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率_______(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2 )=c(H2)=0.13mol/L,则此时正、逆反应速率的大小:v正 _______ v逆 (填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为_____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量_____ (填“增大”、“减小”或“不变”)。
【答案】1A降低<<9.1%不变
【解析】
(1)在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,则起始浓度c(CO)=0.06mol/L,c(H2O)=0.06mol/L,平衡时c(CO2)=0.03mol/L,则
CO(g) + H2O(g) CO2(g)+ H2(g)
起始浓度/molL﹣1:0.06 0.06 0 0
转化浓度/molL﹣1:0.03 0.03 0.03 0.03
平衡浓度/molL﹣1:0.03 0.03 0.03 0.03
反应开始至达到平衡时,平衡常数K= K=c(H2)/c(CO2)/ c(CO)×c(H2O)=0.032/0.032=1;综上所述,本题答案是:1。
(2)平衡常数K只受温度的影响,该反应为ΔH>0,升高温度,平衡右移,平衡常数K增大,因此A选项正确;因此本题答案是:A。
(3)可逆反应中增大一种反应物的浓度,则另一种反应物的转化率会增大,所以若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,CO的转化率升高,而水蒸气的转化率降低;因此,本题答案是:降低。
(4)根据浓度商:QC= c(H2)/c(CO2)/c(CO)×c(H2O)=0.132/0.092=2.09>1,反应逆向移动,v正 <v逆;因此,本题答案是:<。
Ⅱ、①lgK与K是增比例函数,温度越高K值越小,说明该反应正反应为放热反应,ΔH<0;因此,本题答案是:<。
②当lgK=1,K=10,在PbO(s)+CO(g)![]() Pb(s)+CO2(g)反应中,设起始CO:amol/L;达平衡时转化量为xmol/L,平衡时CO为(a-x)mol/L,CO2的浓度为xmol/L,则K=10=x/(a-x),x/a×100%=9.1%;若向容器中充入一定量的CO气体后,平衡正向移动,由于相当于加压,气体分子数不变,所以在此达到平衡时,CO的转化率不变;综上所述,本题答案是:9.1% ;不变。
Pb(s)+CO2(g)反应中,设起始CO:amol/L;达平衡时转化量为xmol/L,平衡时CO为(a-x)mol/L,CO2的浓度为xmol/L,则K=10=x/(a-x),x/a×100%=9.1%;若向容器中充入一定量的CO气体后,平衡正向移动,由于相当于加压,气体分子数不变,所以在此达到平衡时,CO的转化率不变;综上所述,本题答案是:9.1% ;不变。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】某工厂将制革工业污泥中的铬元素以难溶物CrOH(H2O)5SO4的形式回收,工艺流程如下,其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。

回答下列问题:
(1)4.8 mol/L的硫酸溶液密度为1.27g/cm3,该溶液中硫酸的质量分数是_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
①Cr (OH)3溶解于NaOH溶液时反应的离子方程式是___________。
②加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是______________________________。
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____________。
(5)写出上述流程中用SO2进行还原时发生反应的化学方程式:_______________。
【题目】已知 :2SO2(g)+ O2(g)![]() 2SO3(g) △H= -QkJ/mol,在温度一定、容积为2L的密闭容器中分别进行下列三个实验:充分作用后,测得实验1反应放出的热量为Q1kJ,实验2没有热量变化,则下列说法中不正确的是( )
2SO3(g) △H= -QkJ/mol,在温度一定、容积为2L的密闭容器中分别进行下列三个实验:充分作用后,测得实验1反应放出的热量为Q1kJ,实验2没有热量变化,则下列说法中不正确的是( )
实验编号 | SO2(g) | O2(g) | SO3(g) |
1. | 2mol | 1mol | 0mol |
2. | 1mol | 0.5mol | 1mol |
3. | 1mol | 0.8mol | 1.4mol |
A. 实验1放出的热量值为Q1=0.5Q B. 该条件下的平衡常数为4
C. 实验1中O2的转化率为50% D. 实验3反应放出热量

