题目内容
【题目】化学反应方程式是化学学习的基本工具,本学期在化学反应速率与化学平衡章节学过几个重要的方程式,请你按要求写出:
(1)硫代硫酸钠与稀硫酸溶液反应的离子方程式:________________。
(2)在重铬酸钾的硫酸溶液中的Cr2O72—与CrO42—之间转化的离子方程式:________________。
【答案】S2O32—+2H+ =S↓+SO2↑+H2OCr2O72—+ H2O ![]() 2CrO42—+2H+
2CrO42—+2H+
【解析】
(1)硫代硫酸钠与稀硫酸发生氧化还原反应生成S、二氧化硫和硫酸钠、水,离子反应为S2O32-+2H+=S↓+SO2↑+H2O;因此,本题正确答案是:S2O32-+2H+=S↓+SO2↑+H2O。
(2)Cr2O72-与CrO42-之间转化,铬元素的价态不变,属于非氧化还原反应,遵循原子及电荷守恒,转化的离子反应为Cr2O72-+H2O![]() 2CrO42-+2H+;因此,本题正确答案是:Cr2O72-+H2O
2CrO42-+2H+;因此,本题正确答案是:Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。

 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ、在某一容积为5 L的体积不变的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
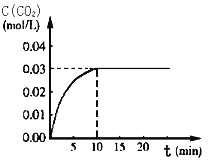
(1)根据图上数据,该温度(800℃)下的平衡常数K=________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有_____(填字母)
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率_______(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2 )=c(H2)=0.13mol/L,则此时正、逆反应速率的大小:v正 _______ v逆 (填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为_____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量_____ (填“增大”、“减小”或“不变”)。