题目内容
下列离子反应方程式正确的是 ( )
铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42― = Cu2++ SO2↑+ 2H2O
少量SO2通入苯酚钠溶液中:C6H5O—+SO2+H2O→C6H5OH+HSO3—
C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=ALO2-+ 2H2O+4NH4+
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2 = 2Fe3++2H2O
D
解析试题分析:A.浓硫酸主要以分子形式存在,不能写成离子形式。错误。B.少量SO2通入苯酚钠溶液中产生亚硫酸钠:2C6H5O—+SO2+H2O→2C6H5OH+SO23—.错误。C.向氯化铝溶液中加入过量氨水。产生的氢氧化铝不能被弱碱溶解。Al3++3NH3·H2O=AL(OH)3↓+3NH4+.错误。D.符合客观事实。正确。
考点:考查离子反应方程式的正确书写的知识。

练习册系列答案
相关题目
下列有关的离子方程式书写正确的是
| A.氢氧化钡溶液和稀硫酸反应:Ba2+ + SO42- = BaSO4↓ |
| B.浓盐酸与铁屑反应:2Fe + 6H+ = 2Fe3+ + 3H2↑ |
| C.SO2通入溴水中:SO2+ Br2+2H2O =SO42-+2Br-+ 4H+ |
| D.钠放于水中:Na + 2H2O = Na++2OH-+H2↑ |
M和N两溶液分别含有下列十二种离子中的五种和七种离子:K+、Na+、H+、NH4+、Fe3+、 A13+、Cl―、OH―、NO3―、S2―、CO32―、SO42―。己知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
| A.OH―、CO32―、SO42― | B.S2―、Cl―、SO42― |
| C.CO32―、NO3―、S2― | D.Cl―、SO42―、NO3― |
下列离子方程式书写正确的是
| A.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全Ba2++OH-+H++ SO42-=BaSO4↓+H2O |
C.服用阿司匹林过量出现水杨酸( )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: + 2 HCO3- → + 2 HCO3- → + 2 CO2↑ + 2 H2O + 2 CO2↑ + 2 H2O |
| D.向FeI2溶液中加少量氯水 2Fe2++Cl2=2Fe3++2Cl- |
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法不正确的是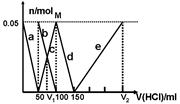
| A.M点时生成的CO2为0mol |
| B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| C.V1:V2=1:4 |
| D.a曲线表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓ |
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
| A.K+、Na+、Br-、SiO32- | B.K+、Na+、Cl-、NO3- |
| C.H+、Fe2+、SO42-、Cl2 | D.K+、Ag+、NH3·H2O、NO3- |
下列离子方程式书写正确的是
A.NaHCO3溶液中的水解:HCO3-+H2O H3O++CO32- H3O++CO32- |
| B.氯化铁溶液中通入硫化氢:2Fe3++H2S=2Fe2++S↓+2H+ |
| C.CaCl2溶液中通入CO2: Ca2++CO2+H2O=CaCO3↓+2H+ |
| D.NaHSO4溶液中逐滴加入Ba(OH)2溶液至恰好呈中性: |
在无色透明的酸性溶液中,能大量共存的离子组是( )
| A.Fe2+、Na+、Cl―、NO3― | B.Ba2+、Al3+、Cl―、NO3― |
| C.K+、Na+、HCO3―、Cl― | D.AlO2-、K+、OH―、Cl― |
下列叙述正确的是
| A.金属单质都能导电,非金属单质都不能导电 |
| B.离子化合物一定不含有共价键 |
| C.只含有共价键的物质一定是非电解质 |
| D.CaCl2在熔融状态下可导电,它是强电解质 |