题目内容
下列叙述正确的是
| A.金属单质都能导电,非金属单质都不能导电 |
| B.离子化合物一定不含有共价键 |
| C.只含有共价键的物质一定是非电解质 |
| D.CaCl2在熔融状态下可导电,它是强电解质 |
D
解析试题分析:石墨是非金属单质,所以不是电解质,但能导电,A选项不正确,共价化合物中不含离子键,离子化合物可以含有共价键,例如氢氧化钠为离子化合物,但是含有共价键,B选项不正确,HCl只含有共价键,但它是电解质,C选项不正确,D选项正确。
考点:考查化学键。

 综合自测系列答案
综合自测系列答案表示下列反应的离子方程式正确的是( )
| A.金属钠加入到CuSO4溶液中: 2Na+Cu2+=Cu+2Na+ |
| B.金属铝加入到NaOH溶液中: Al+2OH-+H2O=AlO2—+2H2↑ |
| C.铁粉加入到FeCl3溶液中:Fe+2Fe3+=3Fe2+ |
| D.铜片插入到AgNO3溶液中:Cu+Ag+=Cu2++Ag |
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
| A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
| B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 |
| C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
(1)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质有许多相似之处。已知锡元素具有如下性质: ;
;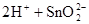



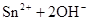 。
。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:_____________________________________________________,_______________________________________。
②将①中溶液蒸干后继续灼烧所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是__________(填化学式)。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱可选用________。
(2)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | 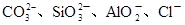 |
| 阳离子 |  |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示。

①若Y是盐酸,则溶液中含有的金属阳离子是_________,ab段发生反应的离子方程式为_______________,图中oa段参加反应的阴离子的物质的量之比为___________________。
②若Y是NaOH溶液,则bc段反应的离子方程式为____________________。
若不考虑离子的水解,忽略H+和OH-的影响,且溶液中只存在四种离子,则它们的离子个数比为_____________________________________________(按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列)。
下列分子或离子在指定的分散系中能大量共存的一组是
| A.溴水溶液:Na+、K+、NO3—、CH3CHO |
| B.氢氧化钠溶液:AlO2—、K+、Cl—、NO3— |
| C.氢氧化铁胶体:H+、K+、S2—、Cl— |
| D.高锰酸钾溶液:H+、Na+、SO42—、CH3CH2OH |
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
| A.氢氧化钠与盐酸;氢氧化钠与碳酸 |
| B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 |
| D.石灰石与硝酸反应;石灰石与盐酸 |
在离子浓度都为0.1 mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是
| A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B.在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- |
| C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- |
| D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+ |
若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A.Al3+ Na+ NO3- Cl- | B.K+ Na+ Cl- NO3- |
| C.K+ Na+ Cl- AlO2- | D.K+ NH4+ SO42- NO3 |