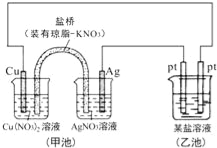
题目内容
【题目】工业废水中含有流失的生产用料、中间产物和产品,以及生产过程中产生的污染物。随着工业的迅速发展,废水的排放量迅速增加,严重威胁人类的健康和安全,工业废水的处理比城市污水的处理更为重要。下图是含铬工业废水和含氰废水的处理流程:
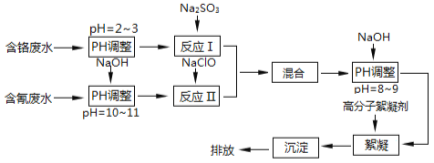
请回答下列问题:
(1)电镀废水中的铬主要以CrO42—形式存在,其中Cr元素的化合价为 。
(2)酸性条件下,CrO42—极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为 。
(3)pH>10时,“反应Ⅱ”中的NaClO可快速地将氰离子(CN—)氧化为无毒的两种物质,这两种物质是 、 (写化学式);若pH<8.5,则生成剧毒的CNCl气体(沸点13.1℃),写出该反应的离子方程式 。
(4)经过“反应Ⅰ”和“反应Ⅱ”将两种废水混合的目的是 。
(5)含氰废水及含铬废水可以通过电化学的方法进行无害化处理。
①可采用惰性电极对含氰废水进行电解,氰离子在碱性条件下被氧化为无毒的物质,该电解工艺中,阳极电极反应式是 。
②电解法处理酸性含铬废水(若铬元素以Cr2O72—形式存在)时,以铁板和石墨作电极,处理过程中存在反应Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O。则阳极的电极反应式为 ,当有1 mol Cr2O72—被还原时,电路中转移的电子为 mol。
【答案】
(1)+6 ;
(2)2CrO42—+3SO32—+10H+=2Cr3++3SO42—+5H2O;
(3)N2、CO32—(或答N2、Na2CO3) ;CN—+ClO—+H2O=CNCl+2OH—;
(4)使两个反应中过量的氧化剂和还原剂反应,以及发生中和反应。
(5)①2 CN—+12OH——10e—=2 CO32—+N2↑+6H2O②Fe—2e—= Fe2+ ;12
【解析】
试题分析:(1)由化合价代数和为0可知CrO42-中Cr元素的化合价为 + 6价,故答案为: + 6;
(2)亚硫酸钠具有还原性,与CrO42-发生氧化还原反应生成Cr3 + 和硫酸钠,反应的离子方程式为2CrO42- + 3SO32- + 10H + = 2Cr3 + + 3SO42- + 5H2O,故答案为:2CrO42- + 3SO32- + 10H + = 2Cr3 + + 3SO42- + 5H2O;
(3)碱性条件下,NaClO将CN-氧化为碳酸根和氮气,碱性条件下生成生成碳酸根离子,反应方程式为:5ClO- + 2CN- + 2OH- = 2CO32- + N2↑ + 5Cl- + H2O,若pH<8.5,则生成剧毒的CNCl气体,反应的离子方程式为CN- + ClO- + H2O = CNCl + 2OH-,故答案为:N2、CO32;CN- + ClO- + H2O = CNCl + 2OH-;
(4)反应Ⅰ、Ⅱ、分别为酸性、碱性,混合可发生中和反应,且分别含有还原性、氧化性物质,可发生氧化还原反应,经过“反应Ⅰ”和“反应Ⅱ”将两种废水混合,可使两个反应中过量的氧化剂和还原剂反应,以及发生中和反应,故答案为:使两个反应中过量的氧化剂和还原剂反应,以及发生中和反应;
(5)①氰离子在碱性条件下被氧化为无毒的物质,应被氧化生成氮气,为阳极反应,电极方程式为2 CN- + 12OH--10e- = 2 CO32- + N2↑ + 6H2O,故答案为:2 CN- + 12OH--10e- = 2 CO32- + N2↑ + 6H2O;
②铁为阳极,可被氧化生成亚铁离子,电极方程式为Fe-2e- = Fe2 + ,反应的关系式为6Fe ~12e- ~ 6Fe2 + ~ Cr2O72-,当有1mol Cr2O72-被还原时,有12mol电子转移,故答案为:Fe-2e- = Fe2 + ;12。

【题目】如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
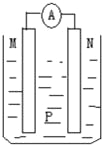
选 项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
【题目】根据下列实验现象,所得结论错误的是
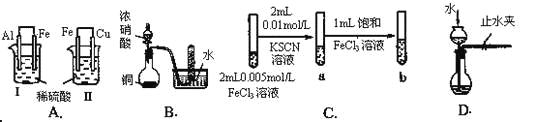
实验 | 实验现象 | 结论 |
A | Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 | 活动性:Al>Fe>Cu |
B | 试管中收集到无色气体 | 铜与浓硝酸反应产物是NO |
C | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D | 长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
【题目】某工厂的废气中含有CO、SO2、NO等有毒气体,为了更有效地治理该废气,某研究小组分别设计了如下两个方案:
方案(1):治理含CO、SO2的烟道气,以Fe2O3作催化剂,将CO、SO2在380℃时转化为S和一种无毒气体。
已知:ⅰ.硫的熔点112.8℃,沸点444.6℃;
ⅱ.反应每得到1mol硫,放出270kJ的热量。
①写出该治理烟道气反应的热化学方程式: 。
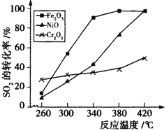
②其他条件相同,催化剂不同时,上述反应中SO2的转化率随反应温度的变化如下图。不考虑催化剂价格因素,生产中选Fe2O3作催化剂的主要原因是 。
方案(2):用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) ![]() N2(g)+CO2(g)。向某容积为2L 的密闭容器中加入NO和足量的活性炭(固体试样体积忽略不计),恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。向某容积为2L 的密闭容器中加入NO和足量的活性炭(固体试样体积忽略不计),恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.32 | 0.32 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.34 | 0.34 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.17 | 0.17 |
①10min~20min以v(CO2)表示的反应速率为 。
②根据表中数据,T1℃时该反应的平衡常数为 (保留两位有效数字)。
③下列各项能作为判断该反应达到平衡状态标志的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,NO的平衡转化率 (填“增大”、“减小”或“不变”)
⑥50min时,保持其他条件不变,往容器中再充入0.32 mol NO和0.34mol CO2,平衡将向 方向移动。