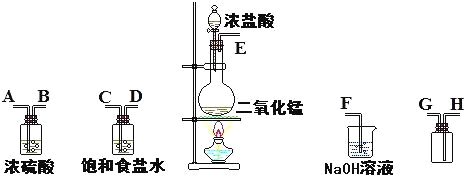
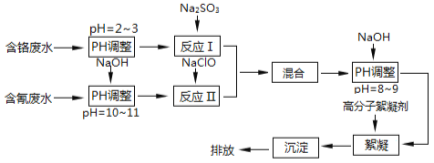
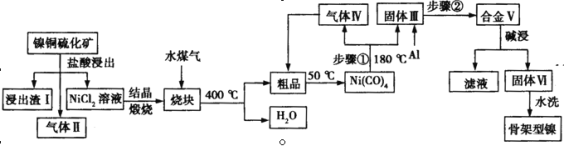
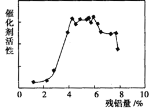
题目内容
【题目】某同学组装了如图所示的电化学装置,则下列说法正确的是( )
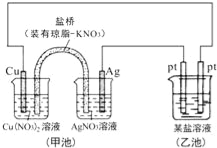
A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO3﹣的浓度不变
C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小
【答案】C
【解析】
试题分析:A、图中甲池为原电池装置,Cu电极为负极发生氧化反应,故A错误;B、实验过程中,铜放电生成铜离子,盐桥中的阴离子硝酸根离子向左边移动,所以左侧烧杯中NO3-的浓度变大,故B错误;C、若甲池中Ag电极质量增加5.4g时,即生成银5.4g,物质的量为![]() =0.05mol,所以整个电路转移0.05mol的电子,如果硝酸银足量应生成5.4g的银,如果是硝酸银说明硝酸银不足,故C正确;D、用铜制U形物代替“盐桥”,右边铜的质量减少,而左边铜的质量增加,而整个电路转移电子数相等,所以减少的质量与增加的质量相等,U型管的质量不变,故D错误;故选C。
=0.05mol,所以整个电路转移0.05mol的电子,如果硝酸银足量应生成5.4g的银,如果是硝酸银说明硝酸银不足,故C正确;D、用铜制U形物代替“盐桥”,右边铜的质量减少,而左边铜的质量增加,而整个电路转移电子数相等,所以减少的质量与增加的质量相等,U型管的质量不变,故D错误;故选C。

 口算能手系列答案
口算能手系列答案【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 最外层电子占核外电子总数的3/8 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,该同位素中子数为8,这种同位素的符号是 .
(2)Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:
(3)Z所在族元素的四种氢化物中,沸点最低的物质的化学式为:
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 (填分子式),阐述理由是 .