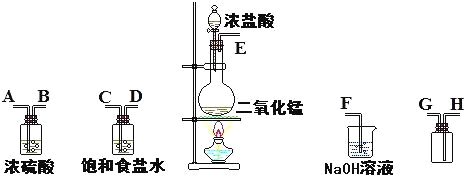
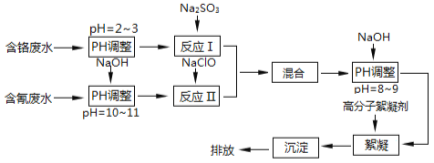
题目内容
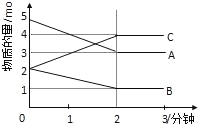
【题目】某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A、B、C均为气体).
(1)该反应的化学方程式为 ;
(2)反应开始至2分钟时,B的平均反应速率为 .
(3)能说明该反应已达到平衡状态的是 .
a.v(A)=2v(B)
b.容器内压强保持不变
c.v逆(A)=v正(C)
d.容器内混合气体的密度保持不变
(4)由如图求得A的平衡时的转化率为 .
【答案】(1)2A+B2C;
(2)0.1mol/(L.min);
(3)bc;
(3)40%.
【解析】
试题分析:(1)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(2)化学反应速率是单位时间内浓度的变化,据此可求得反应速率;
(3)根据平衡状态的判断标志可以作出判断;
(4)根据A达到平衡时已转化的物质的量与起始的物质的量之比,可求得转化率.
解:(1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B2C,
故答案为:2A+B2C;
(2)由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率为![]() =0.1mol/(L.min),
=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
(3)a、v(A)=2v(B)不能说明正反应和逆反应的关系,故无法判断反应是否达到平衡,故a错误;
b、该反应为前后气体体积变小的反应,随着正反应的进行,气体物质的量不断减小,压强也减小,当压强不变时,说明反应已达平衡状态,故b正确;
c、在该反应中A和C的计量数相等,所以当v逆(A)=v正(C)时,可以说明反应已达平衡状态了,故c正确;
d、该反应在5L恒容容器中进行,所有物质又都是气体,所以反应体系的密度始终不变,所以不能作为平衡状态的判断标志,故d错误;
故答案为:bc;
(3)由图可知:达平衡时,△n(A)=2mol,所以A的转化率为![]() ×100%=40%;
×100%=40%;
故答案为:40%.

 智能训练练测考系列答案
智能训练练测考系列答案【题目】分现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
X | 地壳中含量最高的非金属元素 |
Y | M层比K层多1个电子 |
Z | 最外层电子数为内层电子数的0.6倍 |
W | 与氯形成的氯化物是生活中常用的调味品 |
(1)X形成的双原子分子的结构式为 ,X形成的氢化物的沸点在同族元素形成的氢化物中是 (填“最高”或“最低”),原因是 。
(2)金属冶炼Y单质的化学方程式为 。
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为 。
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是 (填化学式),检验该气体的常用试剂 。