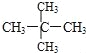
题目内容
【题目】(1)3.6 g H2O的物质的量是________,含有____________________________个水分子,含有________mol H。
(2)11.7 g NaCl的物质的量是________,含有____________个Na+,________________个
Cl-,共含离子________mol。
(3)3.01×1022个OH-的物质的量为________,质量为________,含有质子的物质的量为________,含有电子的物质的量为________,这些OH-与________mol NH3的质量相同,和________g Na+含有的离子数相同。
【答案】(1)0.2 mol 0.2×6.02×1023 0.4
(2)0.2 mol 0.2×6.02×1023 0.2×6.02×1023 0.4
(3)0.05 mol 0.85 g 0.45 mol 0.5 mol 0.05 1.15
【解析】(1)n(H2O)=![]() =0.2 mol,N(H2O)=
=0.2 mol,N(H2O)=![]() =0.2×6.02×1023,一个水分子含有2个氢原子,故含有的氢原子的数目为2×0.2mol=0.4mol。
=0.2×6.02×1023,一个水分子含有2个氢原子,故含有的氢原子的数目为2×0.2mol=0.4mol。
(2)n(NaCl)=![]() =0.2 mol。0.2mol中含有0.2×6.02×102个Na+和0.2×6.02×1023
=0.2 mol。0.2mol中含有0.2×6.02×102个Na+和0.2×6.02×1023
Cl-,两者共0.4摩尔。
(4)n(OH-)=![]() =0.05mol,m(OH-)=n(OH-)×M(OH-)=0.05mol×
=0.05mol,m(OH-)=n(OH-)×M(OH-)=0.05mol×![]() = 0.85 g,一个OH-含有的质子数为9个,电子数目为10个,则0.05 mol OH-含有的质子数目为 0.05mol×9=0.45 mol,电子的数目为0.05mol×10=0.5 mol,OH-与NH3的摩尔质量相同,质量相同的两种物质的物质的量一定相同,故0.05 mol OH-与0.05 mol NH3的质量相同。m(Na+)=
= 0.85 g,一个OH-含有的质子数为9个,电子数目为10个,则0.05 mol OH-含有的质子数目为 0.05mol×9=0.45 mol,电子的数目为0.05mol×10=0.5 mol,OH-与NH3的摩尔质量相同,质量相同的两种物质的物质的量一定相同,故0.05 mol OH-与0.05 mol NH3的质量相同。m(Na+)=![]() ×23
×23![]() =1.15 g。
=1.15 g。

【题目】要配制450mL 0.2molL﹣1FeSO4溶液,实验操作步骤有:
①在天平上称取a g绿矾(FeSO47H2O),将它放在烧杯中,用适量蒸馏水使其完全溶解;
②将所得溶液沿玻璃棒注入容量瓶中;
③继续向容量瓶中加水至液面距刻度线1﹣2cm处,改用胶头滴管滴加蒸馏水至凹液面底部与刻度线相切;
④用少量水洗涤烧杯和玻璃棒2﹣3次,每次洗液都转入容量瓶;
⑤将容量瓶塞紧,充分摇匀.
填写下列空白:
①a g绿矾的实际质量为 g.
②上述操作步骤的正确顺序为 .
③下列操作会使所配溶液的浓度偏高的是 .
A.若配制时遗漏步骤④; |
B.定容时俯视刻度线; |
C.称量时物、码放反了; |
D.绿矾样品已部分风化; |
E.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切;
F.引流时玻璃棒靠在刻度线上方.