题目内容
现有两种金属的混合物共4克,与足量氯气反应后,固体增重7.1克。另取4克该金属混合物,投入到足量盐酸中,产生2.24L(标准状况)H2。则该混合物的组成不可能是
①Cu,Al ②Mg,Fe ③Zn,Al ④Mg,Zn
| A.①② | B.③④ | C.①③ | D.②④ |
A
解析试题分析:两种金属的混合物共4克,与足量氯气反应后,固体增重7.1克为参加反应的氯气,物质的量为0.1mol。另取4克该金属混合物,投入到足量盐酸中,产生2.24L(标准状况)H2,物质的量为0.1mol,在两反应中,4g金属都提供0.2mol电子,结合金属与氯气、盐酸反应金属的化合价判断。①Cu、Al都能与氯气反应,但Cu不能与盐酸反应,相同质量的二者混合物与氯气反应,金属提供的电子大于与盐酸反应提供的电子,故①不可能;②Mg、Fe都与氯气反应,但铁与氯气反应表现+3价,Mg、Fe都与盐酸反应,但铁表现+2价,相同质量的二者混合物与氯气反应,金属提供的电子大于与盐酸反应提供的电子,故②不可能;③Zn,Al都能与氯气、盐酸反应,金属在不同的反应中表现的化合价相同,相同质量的二者混合物与氯气反应,金属提供的电子等于与盐酸反应提供的电子,故③可能;④Mg,Zn都能与氯气、盐酸反应,金属在不同的反应中表现的化合价相同,相同质量的二者混合物与氯气反应,金属提供的电子等于与盐酸反应提供的电子,故④可能,因此答案选A。
考点:考查金属与氯气以及与盐酸反应的有关计算

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案2.7g铝粉分别与体积均为100mL、浓度均为2mol/L的(1)硫酸溶液、(2)烧碱溶液、(3)盐酸完全反应,放出氢气的体积关系(相同条件)是
| A.(1)=(2)=(3) | B.(1)=(2)>(3) |
| C.(1)>(2)>(3) | D.(2)>(1)=(3) |
在标准状况下.0. 56g某气体的体积为448mL,则该气体的相对分子质量为
| A.2 | B.56 | C.14 | D.28 |
用10 mL 0.1 mol·L-1 BaCl2溶液,恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
| A.3∶2∶2 | B.1∶2∶3 | C.3∶1∶1 | D.1∶3∶3 |
下列有关化学用语或名称表达正确的是
A.Mg的原子结构示意图: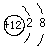 |
B.乙炔的分子结构模型示意图: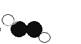 |
C.H2O2的电子式: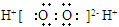 |
D.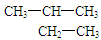 的名称:2-甲基丁烷 的名称:2-甲基丁烷 |
下列溶液中的氯离子浓度 与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是( )
| A.150 mL 1 mol·L-1的NaCl | B.25 mL 2 mol·L-1的FeCl3 |
| C.150 mL 3 mol·L-1的KCl | D.75 mL 2 mol·L-1的CaCl2 |
右图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是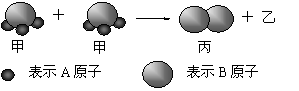
| A.化学反应中分子的种类发生了改变 |
| B.该反应类型是分解反应 |
| C.反应生成的丙物质属于单质 |
| D.根据阿佛加德罗定律可推知,1个乙分子中含有2个A原子 |
150℃时, NH4HCO3分解为NH3、H2O、CO2三种物质,此时混合气的密度是相同条件下的氢气密度的大约
| A.26.3倍 | B.15.25倍 | C.13.2倍 | D.12倍 |
No为阿伏加德罗常数的值。下列叙述正确的是
| A.0℃、l0lkPa下,22.4L氦气含质子的数目为4No |
| B.常温常压下,14g氮气所含共价键数目为3No |
| C.25℃时,1LpH=13的Ba(0H)2溶液所含Ba2+数目为0.1 No |
| D.一定条件F.1.0 mol氯气与足量铁完全反应转移的电子数为2 No |