题目内容
5.将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体.将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为( )| A. | 2:1:1 | B. | 1:1:2 | C. | 1:2:1 | D. | 4:3:3 |
分析 Na、Na2O、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,氢气来源于钠和水的反应,氧气来源于过氧化钠与水的反应,通过钠与水、过氧化钠与水、氢气和氧气反应的方程式,找出钠与过氧化钠的物质的量之比,据此判断.
解答 解:钠与水、过氧化钠与水、氢气与氧气的反应方程式如下:
2Na+2H2O=2NaOH+H2↑ 钠与氢气的关系式为2Na--H2
2Na2O2+2H2O=4NaOH+O2↑ 过氧化钠与氧气的关系式为 2Na2O2--O2
2H2+O2$\frac{\underline{\;放电\;}}{\;}$2H2O 氢气和氧气的关系式为2H2--O2
将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,即氢气和氧气的物质的量之比为2:1,
通过钠与氢气、过氧化钠与氧气、氢气与氧气的关系式可得钠与过氧化钠的关系式为:4Na--2H2--O2--2Na2O2
所以钠与过氧化钠的物质的量之比为4:2=2:1,而氧化钠的物质的量不确定,
显然只有A中符合钠与过氧化钠的物质的量之比为2:1,
故选A.
点评 本题考查无数据计算,难度中等,关键在于氢气与氧气恰好完全反应,根据方程式性质比例关系.

练习册系列答案
相关题目
15.有关18O的叙述正确的是( )
| A. | 与O3中普通氧原子的化学性质不同 | B. | 是O3的同素异形体 | ||
| C. | 与23Na含的中子数相同 | D. | 与16O互为同位素 |
16.以下物质间的每步转化都可以通过一步反应能实现的是( )
| A. | Al→Al2O3→Al(OH)3→Na[Al(OH)4] | B. | Fe→FeO→Fe(OH)2→Fe(OH)3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | Na→Na2O2→Na2CO3→NaOH |
20.下列有关实验方法或描述正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入品红溶液,品红褪色,加热后褪色,一定有SO32- | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
10.有关如图装置中的叙述正确的是( )
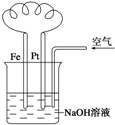

| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是吸氧腐蚀的原电池装置 | |
| C. | Fe为正极,电极反应为:Fe-2e-+2OH-═Fe(OH)2 | |
| D. | NaOH溶液的碱性逐渐减弱 |
17.根据下列短周期元素性质的数据判断,下列说法正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径∕10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.24 |
| 最高价或最低价 | -2 | +2 | +1 | +5 -3 | +7 -1 | +1 | +5 -3 | +3 |
| A. | 元素④⑤形成的化合物是离子化合物 | |
| B. | 元素⑦位于第二周期第V族 | |
| C. | 元素①⑧形成的化合物具有两性 | |
| D. | 元素③的最高价氧化物对应水化物的碱性最强 |
14.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. | 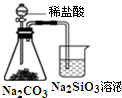 图所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 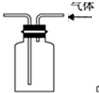 用图所示实验装置排空气法收集CO2气体 | |
| C. | 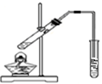 用图装置制备少量乙酸乙酯 | |
| D. | 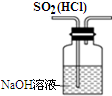 图装置可以用来除去SO2中的HCl |
15.以下化石能源的加工所得产品不符合事实的是( )
| A. | 石油分馏-乙炔 | B. | 石油裂解-乙烯 | ||
| C. | 煤焦油分馏-苯酚 | D. | 天然气热分解-炭黑 |