题目内容
(Ⅰ)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
(1)25℃、101kPa时,1mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为: .
(2)甲醇燃料电池的结构示意图如图1.甲醇进入 极(填“正”或“负”),写出该极的电极反应式 .

(Ⅱ)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是 电解液中H2SO4的浓度将变 ;
(2)在完全放电耗尽PbO2和Pb时,若按图2连接,电解一段时间后,则在A电极上生成 B电极上生成 .
(1)25℃、101kPa时,1mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为:
(2)甲醇燃料电池的结构示意图如图1.甲醇进入

(Ⅱ)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
(1)放电时:正极的电极反应式是
(2)在完全放电耗尽PbO2和Pb时,若按图2连接,电解一段时间后,则在A电极上生成
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(Ⅰ)(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,以此书写热化学方程式;
(2)甲醇燃料电池中,甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳;
(Ⅱ)(1)电池总反应式为:Pb+PbO2+4H++2SO42-
2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++SO42-=PbSO4+2H2O,依据电解反应和电池原理分析判断;
(2)装置中使电解装置,电极上是析出的硫酸铅,所以是铅蓄电池的充电过程,依据电解原理分析.
(2)甲醇燃料电池中,甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳;
(Ⅱ)(1)电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
(2)装置中使电解装置,电极上是析出的硫酸铅,所以是铅蓄电池的充电过程,依据电解原理分析.
解答:
解:(Ⅰ)(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,则燃烧的热化学方程式为CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol,
故答案为:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.51 kJ/mol;
(2)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,电极反应为CH3OH+H2O-6e-=CO2+6H+,
故答案为:负;CH3OH+H2O-6e-═CO2+6H+;
(Ⅱ)(1)电池总反应式为:Pb+PbO2+4H++2SO42-
2PbSO4+2H2O,写出电极反应为:负极电极反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++SO42-=PbSO4+2H2O,电解液中H2SO4的浓度将减小,
故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;小;
(2)在完全放电耗尽PbO2和Pb时,电极上是析出的PbSO4,若按题右图连接B为阳极应是失去电子发生氧化反应,A为阴极是得到电子发生还原反应,实质是电解反应,B电极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,A电极发生反应为:PbSO4=Pb-2e-+SO42-,所以A电极上生成Pb;B极生成PbO2,故答案为:Pb;PbO2.
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,电极反应为CH3OH+H2O-6e-=CO2+6H+,
故答案为:负;CH3OH+H2O-6e-═CO2+6H+;
(Ⅱ)(1)电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;小;
(2)在完全放电耗尽PbO2和Pb时,电极上是析出的PbSO4,若按题右图连接B为阳极应是失去电子发生氧化反应,A为阴极是得到电子发生还原反应,实质是电解反应,B电极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,A电极发生反应为:PbSO4=Pb-2e-+SO42-,所以A电极上生成Pb;B极生成PbO2,故答案为:Pb;PbO2.
点评:本题为综合题,涉及反应热的计算、热化学反应方程式的书写、燃料电池以及铅蓄电池的工作原理和电极反应的书写等知识点,注重高考常考考点的考查,题目难度中等,注意把握原电池的工作原理和电极方程式的书写,为解答该题的关键.

练习册系列答案
相关题目
淀粉已水解,但水解不完全的特征是( )
| A、既能发生银镜反应,又能使碘溶液变蓝色 |
| B、既能发生银镜反应,又能和新制Cu(OH)2反应生成红色沉淀 |
| C、既有甜味,又不很甜 |
| D、不能使碘溶液变蓝,却发生银镜反应 |
氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和1/2O2+H2O+2e-=2OH-,则下列叙述正确的是( )
| A、通H2的一极是正极,通O2的一极是负极 |
| B、通O2的一极是正极,通H2的一极是负极 |
| C、工作一段时间后电解质溶液pH增大 |
| D、工作时负极区附近pH减小 |
下列说法不正确的是( )
| A、干馏煤可以得到甲烷、苯、和煤焦油等重要化工原料 |
| B、淀粉、纤维素和脂肪在一定条件下都可以发生水解反应 |
| C、用大米酿的酒在一定条件下密封保存,时间越长越香醇 |
| D、“乙醇汽油”是在汽油中加入乙醇生成的一种新化合物 |
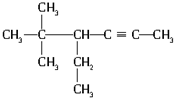 的系统名称为
的系统名称为