题目内容
计算下列各题:
(1)用pH=2的盐酸中和pH=12的NaOH溶液,所用盐酸V(酸)和氢氧化钠溶液V(碱)的体积比是V(酸)﹕V(碱)= ;
(2)用pH=3的盐酸中和pH=12的NaOH溶液,所用盐酸V(酸)和氢氧化钠溶液V(碱)的体积比是V(酸)﹕V(碱)= ;
(3)用pH=a的盐酸中和pH=b的NaOH溶液,所用盐酸V(酸)和氢氧化钠溶液V(碱)的体积比是V(酸)﹕V(碱)= .
(1)用pH=2的盐酸中和pH=12的NaOH溶液,所用盐酸V(酸)和氢氧化钠溶液V(碱)的体积比是V(酸)﹕V(碱)=
(2)用pH=3的盐酸中和pH=12的NaOH溶液,所用盐酸V(酸)和氢氧化钠溶液V(碱)的体积比是V(酸)﹕V(碱)=
(3)用pH=a的盐酸中和pH=b的NaOH溶液,所用盐酸V(酸)和氢氧化钠溶液V(碱)的体积比是V(酸)﹕V(碱)=
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)pH=2的盐酸中氢离子浓度为0.01mol/L,pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,二者都是强电解质,恰好反应时溶液显示中性,根据n(OH-)=c(H+)计算出两溶液的体积之比;
(2)pH=3的盐酸中氢离子浓度为0.001mol/L,pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,二者都是强电解质,恰好反应时溶液显示中性,根据n(OH-)=c(H+)计算出两溶液的体积之比;
(3)pH=a的盐酸中氢离子浓度为:c(H+)=10a+b-pHmol/L,pH=b的NaOH溶液中氢氧根离子浓度为c(OH-)=10pH-14mol/L,二者都是强电解质,恰好反应时溶液显示中性,根据n(OH-)=c(H+)计算出两溶液的体积之比.
(2)pH=3的盐酸中氢离子浓度为0.001mol/L,pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,二者都是强电解质,恰好反应时溶液显示中性,根据n(OH-)=c(H+)计算出两溶液的体积之比;
(3)pH=a的盐酸中氢离子浓度为:c(H+)=10a+b-pHmol/L,pH=b的NaOH溶液中氢氧根离子浓度为c(OH-)=10pH-14mol/L,二者都是强电解质,恰好反应时溶液显示中性,根据n(OH-)=c(H+)计算出两溶液的体积之比.
解答:
解:(1)氯化氢和氢氧化钠都是强电解质,pH=2的盐酸中氢离子浓度为0.01mol/L,pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,恰好反应时溶液显示中性,则:n(OH-)=c(H+),即:0.01mol/L×V(酸)=0.01mol/L×V(碱),解得:V(酸)﹕V(碱)=1:1,
故答案为:1:1;
(2)氯化氢和氢氧化钠都是强电解质,pH=3的盐酸中氢离子浓度为0.001mol/L,pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,恰好反应时溶液显示中性,则:n(OH-)=c(H+),即:0.001mol/L×V(酸)=0.01mol/L×V(碱),解得:V(酸)﹕V(碱)=10:1,
故答案为:10:1;
(3)pH=a的盐酸中氢离子浓度为:c(H+)=10a+b-pHmol/L=10a+b-amol/L,pH=b的NaOH溶液中氢氧根离子浓度为c(OH-)=10pH-14mol/L=10a+bb-14mol/L,二者都是强电解质,恰好反应时溶液显示中性,则:n(OH-)=c(H+),即10a+b-amol/L×V(酸)=10a+bb-14mol/L×V(碱),解得:V(酸)﹕V(碱)=10a+ba+b-14,
故答案为:10a+ba+b-14﹕1.
故答案为:1:1;
(2)氯化氢和氢氧化钠都是强电解质,pH=3的盐酸中氢离子浓度为0.001mol/L,pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,恰好反应时溶液显示中性,则:n(OH-)=c(H+),即:0.001mol/L×V(酸)=0.01mol/L×V(碱),解得:V(酸)﹕V(碱)=10:1,
故答案为:10:1;
(3)pH=a的盐酸中氢离子浓度为:c(H+)=10a+b-pHmol/L=10a+b-amol/L,pH=b的NaOH溶液中氢氧根离子浓度为c(OH-)=10pH-14mol/L=10a+bb-14mol/L,二者都是强电解质,恰好反应时溶液显示中性,则:n(OH-)=c(H+),即10a+b-amol/L×V(酸)=10a+bb-14mol/L×V(碱),解得:V(酸)﹕V(碱)=10a+ba+b-14,
故答案为:10a+ba+b-14﹕1.
点评:本题考查了酸碱混合的定性判断及溶液酸碱性与溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确酸碱中和反应实质为解答本题的关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
下列叙述不正确的是( )
| A、NH3易液化,液氨常用做制冷剂 |
| B、与金属反应时,稀HNO3可能被还原为更低价态,则稀硝酸氧化性强于浓硝酸 |
| C、氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
| D、活泼金属不能从稀硝酸中置换出氢气 |
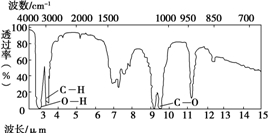 有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题: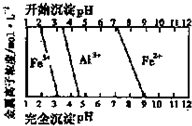 氧化铁在工业上具有广泛的应用.
氧化铁在工业上具有广泛的应用.

