题目内容
【题目】常温下,向0.1mol·L1二元弱酸H2A的溶液中逐滴加入NaOH溶液,H2A、HA-、A2的物质的量分数随pH的变化如图所示。下列叙述正确的是( )
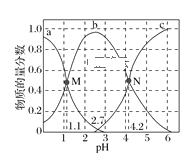
A.a曲线代表HA的物质的量分数随pH的变化
B.M点pH=1.1时,溶液中微粒浓度关系为c(H+)>c(HA)=c(H2A)
C.pH=2.7时,c(A2)+c(HA)+c(H2A)=0.1mol·L1
D.N点pH=4.2时,c(A2)=c(HA),溶液中不存在H2A分子
【答案】B
【解析】
向二元弱酸H2A溶液中逐滴加入NaOH溶液,发生H2A+OH-=HA-+H2O、HA-+OH-=H2O+A2-,然后结合图象以及守恒关系进行分析。
A、向二元弱酸H2A中逐滴加入NaOH溶液,依次发生反应:H2A+OH-=HA-+H2O、HA-+OH-=H2O+A2-,结合题图可知,a曲线代表H2A的物质的量分数随pH的变化,b曲线代表HA-的物质的量分数随pH的变化,c曲线代表A2-的物质的量分数随pH的变化,故A错误;
B、pH=1.1时,溶液中c(H+)=10-1.1mol/L,根据图可知,c(HA-)=c(H2A)<0.05mol·L-1,因此有c(H+)>c(HA-)=c(H2A),故B正确;
C、当pH=2.7时,因滴入NaOH溶液,溶液的体积增大,结合物料守恒可知c(H2A)+c(HA-)+c(A2-)<0.1mol·L-1,故C错误;
D、N点时,c(A2-)=c(HA-),但溶液中仍存在H2A分子,只不过其浓度很小,故D错误;
答案选B。

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目