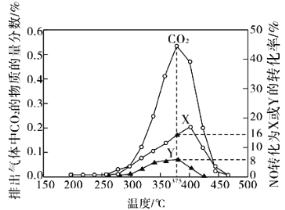
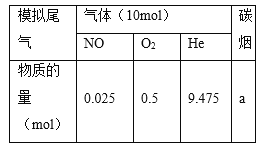
题目内容
【题目】一种新型高效净水剂PAFC--聚合氯化铁铝![]()
![]() ,
,![]() ,
,![]() 广泛用于生活用水的净化和废水的净化
广泛用于生活用水的净化和废水的净化
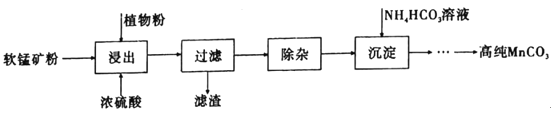
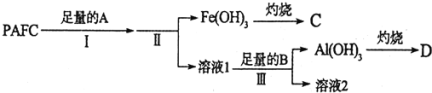
![]() 为测定PAFC中Al的含量,采用如图所示流程进行.
为测定PAFC中Al的含量,采用如图所示流程进行.
回答下列问题:
![]() 有关PAFC的说法正确的是 ______
有关PAFC的说法正确的是 ______
A PAFC中铁显![]() 价
价
B PAFC用于净化饮用水时,可以除去水中所有的有害物质
C PAFC用于净水时,比用相同量的氯化铝和氯化铁对水的pH改变小
D PAFC在强酸性或强碱性溶液中都能稳定存在
![]() 步骤I中的试剂A是 ______
步骤I中的试剂A是 ______ ![]() 填“氨水”或“氢氧化钠溶液”
填“氨水”或“氢氧化钠溶液”![]()
![]() 步骤III的离子方程式为 ______ .
步骤III的离子方程式为 ______ .
![]() 实验室进行“灼烧”时所需的陶瓷仪器有 ______ .
实验室进行“灼烧”时所需的陶瓷仪器有 ______ .
![]() 溶液2中存在的电荷守恒式为 ______ ;向溶液2中滴加少量NaOH镕液,则
溶液2中存在的电荷守恒式为 ______ ;向溶液2中滴加少量NaOH镕液,则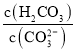 ______填“变大”、“变小”或“不变”
______填“变大”、“变小”或“不变”![]() .
.
![]() 已知C和某一金属在高温下发生反应可用于焊接钢轨,某同学在实验室中进行此反应,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,由此该同学确定该固体混合物中无
已知C和某一金属在高温下发生反应可用于焊接钢轨,某同学在实验室中进行此反应,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,由此该同学确定该固体混合物中无![]() ,他的判断是否正确?说明理由.
,他的判断是否正确?说明理由.![]() 可用文字或离子方程式解释理由
可用文字或离子方程式解释理由![]() .______ .
.______ .
![]() 有资料介绍:溶液中铝元素以氢氧化物
有资料介绍:溶液中铝元素以氢氧化物![]() 用
用![]() 表示
表示![]() 形式存在的pH范围是
形式存在的pH范围是![]() 现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 ______ .
现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 ______ .
【答案】C 氢氧化钠溶液 ![]() 瓷坩埚、泥三角、酒精灯
瓷坩埚、泥三角、酒精灯 ![]() 变小 否,
变小 否,![]()
![]()
【解析】
(1)为检测PAFC中Al和Fe含量,PAFC加入足量A为NaOH溶液,反应生成Fe(OH)3沉淀和NaAlO2溶液、NaCl溶液;过滤后得到Fe(OH)3灼烧得到C为Fe2O3,滤液Ⅰ中通入过量的B为CO2气体,和NaAlO2溶液反应生成Al(OH)3沉淀,过滤得到Al(OH)3沉淀,灼烧得到D为Al2O3;
①A、阴离子总价态:6-n+n=6,铝只有+3价,所以Fe就是6-3=3,外面的m只是表示这样一个分子聚合度,与价态无关,A错误;
B、净化饮用水时可看做FeCl3、AlCl3水解生成的Fe(OH)3胶体、Al(OH)3胶体,具有吸附悬浮杂质的作用,但不能消毒杀菌,B错误;
C、PAFC用于净水时,OH-的存在对水的电离起到抑制作用,比用相同量的AlCl3和FeCl3对水的pH改变小,C正确;
D、PAFC是碱式复盐,在强酸性和强碱性溶液中都不能稳定存在,D错误;
故选C;
②步骤Ⅰ中的试剂A为氢氧化钠溶液;
③步骤Ⅲ的反应为NaAlO2溶液中通入过量CO2气体生成Al(OH)3沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
④实验室进行“灼烧”是灼烧Al(OH)3固体,固体灼烧所需陶瓷仪器为坩埚、泥三角、酒精灯;
⑤溶液2为NaHCO3溶液和NaCl溶液,溶液中阴阳离子所带电荷数相同,溶液中存在电荷守恒为:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),向溶液2中滴加少量NaOH溶液和NaHCO3反应生成Na2CO3和H2O,c(CO32-)增大,c(H2CO3)减小,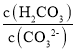 比值减小;
比值减小;
(2)铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无Fe3+,但不能说明固体中不含Fe2O3,因为铝热反应生成铁可以还原Fe3+为Fe2+,离子方程式为:Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+,反应结束后将所得固体溶于足量的稀H2SO4,滴加KSCN溶液无明显现象,不能确定该固体混合物中无Fe2O3;
(3)A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,说明溶液呈酸性是因为Al3+水解,溶液呈碱性为NaAlO2溶液水解显碱性;混合后水解相互促进反应生成Al(OH)3沉淀;反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓。