题目内容
[化学--选修3:物质结构与性质]W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为msnmpn.请回答下列问题:
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是______,该分子中含有______个π键.
(2)Z原子的核外电子排布式为______;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为______.
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于______晶体;Q、R、X三种元素的第一电
离能数值由小到大的顺序为______(用元素符号回答).
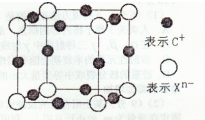
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示.该晶体中阳离子和阴离子个数比为______,晶体中每个Xn-被______个等距离的C+离子包围.

(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是______,该分子中含有______个π键.
(2)Z原子的核外电子排布式为______;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为______.
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于______晶体;Q、R、X三种元素的第一电
离能数值由小到大的顺序为______(用元素符号回答).
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示.该晶体中阳离子和阴离子个数比为______,晶体中每个Xn-被______个等距离的C+离子包围.
W原子1s轨道上只有一个电子,所以W为氢,Q、X原子p轨道的电子数分别为2和4,则Q、X分别为:碳、氧;Q、R、X三种元素的原子序数逐渐增大,所以R为氮,Y价电子:msnmpn中n只能取2,又为短周期,则Y可能为C或Si,又因Y的原子序数比X(氧)大,所以Y为硅,Z的原子序数为29,则Z为铜,故可推出:W为氢,Q为碳,R为氮,X为氧,Y为硅,Z为铜.
(1)C2H4的结构简式为CH2=CH2,中心原子C原子采取的杂化轨道类型为SP2,C-H之间单键是σ键,C=C叁键中有1个是σ键一个π键,所以分子中含有1个π键,故答案为:SP2;1;
(2)铜为29号元素,铜:1s22s22p63s23p63d104S1;因铜离子能与氮原子形成配位键,所以晶体中铜离子与NH3之间的化学键为配位键,故答案为:1s22s22p63s23p63d104S1;配位键;
(3)因同一周期从左到右元素的电负性逐渐增强,同一主族元素从上到下元素的电负性呈减小的趋势,所以电负性最强的非金属元素为N,最小的为Si,两者形成的化学式为Si3N4,为原子晶体;因同一周期从左到右元素的第一电离呈增大的趋势,碳、氮、氧的电离能呈增大趋势,但由于氮的P轨道半充满,第一电离能出现反常,比氧高,所以三种元素的第一电离能数值由小到大的顺序为:C<O<N,故答案为:原子晶体;C<O<N;
(4)一个晶胞中阳离子的个数为12×
=3,阴离子个数为:8×
=1,然后求出两者的个数之比为3:1;根据以Xn-为中心,在X、Y、Z三个轴上,在每个轴上等距离的C+有2个,共6个,故答案为:3:1;6;
(1)C2H4的结构简式为CH2=CH2,中心原子C原子采取的杂化轨道类型为SP2,C-H之间单键是σ键,C=C叁键中有1个是σ键一个π键,所以分子中含有1个π键,故答案为:SP2;1;
(2)铜为29号元素,铜:1s22s22p63s23p63d104S1;因铜离子能与氮原子形成配位键,所以晶体中铜离子与NH3之间的化学键为配位键,故答案为:1s22s22p63s23p63d104S1;配位键;
(3)因同一周期从左到右元素的电负性逐渐增强,同一主族元素从上到下元素的电负性呈减小的趋势,所以电负性最强的非金属元素为N,最小的为Si,两者形成的化学式为Si3N4,为原子晶体;因同一周期从左到右元素的第一电离呈增大的趋势,碳、氮、氧的电离能呈增大趋势,但由于氮的P轨道半充满,第一电离能出现反常,比氧高,所以三种元素的第一电离能数值由小到大的顺序为:C<O<N,故答案为:原子晶体;C<O<N;
(4)一个晶胞中阳离子的个数为12×
| 1 |
| 4 |
| 1 |
| 8 |

练习册系列答案
相关题目
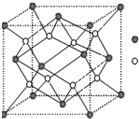
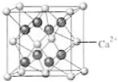 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是