题目内容
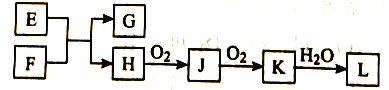
【题目】实验室利用如图所示的装置及药品制取氨气。

(1)A中发生反应的化学方程式为__________________。
(2)B中盛放的试剂名称为___________________。
(3)C为用集气瓶收集氨气的装置,请绘出完装置图___________________。
(4)证明氨气已收集满的操作和现象为_____________。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 碱石灰
CaCl2+2NH3↑+2H2O 碱石灰  将湿润的红色石蕊试纸靠近C右侧的导管口,试纸变蓝色
将湿润的红色石蕊试纸靠近C右侧的导管口,试纸变蓝色
【解析】
实验室制氨气用Ca(OH)2和NH4Cl固体加热制取,由于NH3遇水显碱性,干燥NH3需要使用碱石灰;由于NH3密度比空气小,且极易溶于水,所以用向下排空气法收集。
(1)A中是实验室制取氨气的反应,反应方程式为: Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)根据分析,干燥氨气一般使用碱石灰,所以B里面的试剂为碱石灰。
(3)根据分析,氨气的密度比空气小,且极易溶于水,不能使用排水法收集,可以用向下
排空气法收集,因此C中的装置图需要用一个正立的集气瓶,导管要短进长出,图像为: 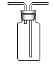
(4)氨气溶于水显碱性:NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4++OH-,可使湿润的石蕊试纸变蓝。因此操作为:将湿润的红色石蕊试纸靠近C右侧的导管口,试纸变成蓝色。
NH4++OH-,可使湿润的石蕊试纸变蓝。因此操作为:将湿润的红色石蕊试纸靠近C右侧的导管口,试纸变成蓝色。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验小组同学对乙醛与新制的Cu(OH)2反应的实验进行探究。
实验Ⅰ:取2mL 10%的氢氧化钠溶液于试管中,加入5滴2%的CuSO4溶液和5滴5%的乙醛溶液,加热时蓝色悬浊液变黑,静置后未发现红色沉淀。
实验小组对影响实验Ⅰ成败的因素进行探究:
(1)探究乙醛溶液浓度对该反应的影响。
编号 | 实验Ⅱ | 实验Ⅲ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变红棕色,静置后底部有大量红色沉淀 | 加热,蓝色悬浊液变红棕色,静置后上层为棕黄色油状液体,底部有少量红色沉淀 |
已知:乙醛在碱性条件下发生缩合反应:CH3CHO+CH3CHO![]() CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
① 能证明乙醛被新制的Cu(OH)2 氧化的实验现象是______。
② 乙醛与新制的Cu(OH)2 发生反应的化学方程式是______。
③ 分析实验Ⅲ产生的红色沉淀少于实验Ⅱ的可能原因:______。
(2)探究NaOH溶液浓度对该反应的影响。
编号 | 实验Ⅳ | 实验Ⅴ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,蓝色悬浊液变红棕色, 静置后底部有红色沉淀 |
依据实验Ⅰ→Ⅴ,得出如下结论:
ⅰ. NaOH溶液浓度一定时,适当增大乙醛溶液浓度有利于生成Cu2O。
ⅱ. 乙醛溶液浓度一定时,______。
(3)探究NaOH溶液浓度与乙醛溶液浓度对该反应影响程度的差异。
编号 | 实验Ⅵ | 实验Ⅶ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,静置后底部有红色沉淀 |
由以上实验得出推论: ______。
【题目】下列实验操作及现象能够达成相应实验结论的是( )
选项 | 实验操作及现象 | 结论 |
A | 向某溶液中加入BaCl2溶液,有白色沉淀生成 | 溶液中一定含有 |
B | 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色气体 | 溶液中一定含有 |
C | 向某溶液中先加入盐酸酸化,没有明显现象,再加入BaCl2溶液,有白色沉淀产生 | 溶液中一定含有SO42- |
D | 向5mL饱和氯水中滴加少量0.1 mol/L NaBr溶液,溶液由无色变为橙黄色,再滴加足量0.1 mol/L淀粉-KI溶液,溶液变蓝 | 氧化性强弱:Cl2>Br2>I2 |
A.AB.BC.CD.D
【题目】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(主要成份是ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c(Mn+)=0.10mol·L–1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.3 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)写出ZnS的电子式__________________________;
焙烧过程中主要反应的化学方程式为__________________________。
(2)滤渣1的成分为:___________________;
(3)试剂Y是_________(只要求填写一种), 调PH值的范围是___________________。
(4)电解硫酸锌溶液制备单质锌时,电解的总反应离子方程式为:___________________。
(5)为将溶液中的Fe2+氧化,试剂X可选用的是_______。(填序号)
A.H2O2 B.H2S C.HNO3 D.O2