题目内容
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )
分析:根据“谁强谁显性、谁弱谁水解”确定溶液酸碱性,从而确定溶液pH大小,注意碳酸根离子水解能力大于碳酸氢根离子.
解答:解:A.碳酸氢钠和碳酸钠都是强碱弱酸盐,其溶液呈碱性,氯化钠是强酸强碱盐,其溶液呈中性,氯化铵是强酸弱碱盐其溶液呈酸性,但碳酸氢根离子水解能力小于碳酸根离子,相同浓度时水解能力越大其碱性越强,所以pH从小到大顺序是NH4Cl<NaCl<NaHCO3<Na2CO3,故A错误;
B.碳酸氢钠和碳酸钠都是强碱弱酸盐,其溶液呈碱性,氯化钠是强酸强碱盐,其溶液呈中性,氯化铵是强酸弱碱盐其溶液呈酸性,但碳酸氢根离子水解能力小于碳酸根离子,相同浓度时水解能力越大其碱性越强,所以pH从小到大顺序是NH4Cl<NaCl<NaHCO3<Na2CO3,故B错误;
C.硫酸铵和氯化铵都是强酸弱碱盐其溶液呈酸性,硝酸钠是强酸强碱盐其溶液呈中性,硫化钠是弱酸强碱盐其溶液呈碱性,但硫酸铵铵离子浓度大于氯化铵,所以硫酸铵水解出氢离子浓度大于氯化铵,则硫酸铵的pH小于氯化铵,故C正确;
D.硝酸钠是强酸强碱盐其溶液呈中性,硫化钠是弱酸强碱盐其溶液呈碱性,所以相同浓度的硝酸钠和硫化,硫化钠的pH大于硝酸钠,故D错误;
故选C.
B.碳酸氢钠和碳酸钠都是强碱弱酸盐,其溶液呈碱性,氯化钠是强酸强碱盐,其溶液呈中性,氯化铵是强酸弱碱盐其溶液呈酸性,但碳酸氢根离子水解能力小于碳酸根离子,相同浓度时水解能力越大其碱性越强,所以pH从小到大顺序是NH4Cl<NaCl<NaHCO3<Na2CO3,故B错误;
C.硫酸铵和氯化铵都是强酸弱碱盐其溶液呈酸性,硝酸钠是强酸强碱盐其溶液呈中性,硫化钠是弱酸强碱盐其溶液呈碱性,但硫酸铵铵离子浓度大于氯化铵,所以硫酸铵水解出氢离子浓度大于氯化铵,则硫酸铵的pH小于氯化铵,故C正确;
D.硝酸钠是强酸强碱盐其溶液呈中性,硫化钠是弱酸强碱盐其溶液呈碱性,所以相同浓度的硝酸钠和硫化,硫化钠的pH大于硝酸钠,故D错误;
故选C.
点评:本题考查了溶液pH大小的平衡,先将盐根据其相应酸碱的强弱分类,再根据弱根离子的水解程度分类,从而比较pH相对大小,难度中等.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
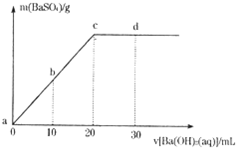 常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )| A、溶液的导电能力:a>b>c>d | B、溶液的pH:a<b<c<d | C、c点溶液和d点溶液均呈碱性 | D、b点溶液中c(H+)和d点溶液中c(OH-)相等 |