题目内容
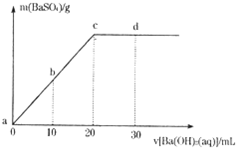 常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )| A、溶液的导电能力:a>b>c>d | B、溶液的pH:a<b<c<d | C、c点溶液和d点溶液均呈碱性 | D、b点溶液中c(H+)和d点溶液中c(OH-)相等 |
分析:A、导电能力与溶液中自由移动离子的浓度有关,离子浓度越大,导电能力越强;
B、溶液中氢离子的浓度逐渐降低,溶液的pH 值逐渐增大;
C、溶液的酸碱性就比较氢离子和氢氧根离子浓度的相对大小;
D、根据反应方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O,来比较b点溶液中c(H+)和d点溶液中c(OH-).
B、溶液中氢离子的浓度逐渐降低,溶液的pH 值逐渐增大;
C、溶液的酸碱性就比较氢离子和氢氧根离子浓度的相对大小;
D、根据反应方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O,来比较b点溶液中c(H+)和d点溶液中c(OH-).
解答:解:A、导电能力与溶液中自由移动离子的浓度有关,离子浓度越大,导电能力越强,随着氢氧化钡溶液的加入,溶液中硫酸根离子和氢离子逐渐减少,当达到c点时,硫酸和氢氧化钡恰好反应生成硫酸钡和水,溶液的导电性最小,继续滴加氢氧化钡溶液时,氢氧化钡是可溶性的强电解质,溶液中自由移动的离子浓度增大,导电性逐渐增强,所以导电能力是先减小后增大,故A错误;
B、硫酸和氢氧化钡的反应方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O,随着氢氧化钡溶液的加入,溶液中氢离子的浓度逐渐降低,溶液的PH 值逐渐增大,当达到c点时,硫酸和氢氧化钡恰好反应生成硫酸钡和水,溶液的pH=7,继续滴加氢氧化钡溶液,溶液的pH>7,故B正确;
C、c处,硫酸和氢氧化钡恰好反应生成硫酸钡和水,溶液呈中性;d处氢氧化钡溶液过量导致溶液呈碱性,故C错误;
D、硫酸和氢氧化钡的反应方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O,溶液混合前硫酸的物质的量浓度和氢氧化钡的物质的量浓度相同,根据图象知,滴加氢氧化钡溶液20mL时,两种溶液恰好反应,所以硫酸的体积为20mL,b点时,氢离子的物质的量浓度=
=
mol/L;d点时氢氧根离子的物质的量浓度=×
=
mol/L,所以两处的物质的量浓度不同,故D错误;
故选B.
B、硫酸和氢氧化钡的反应方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O,随着氢氧化钡溶液的加入,溶液中氢离子的浓度逐渐降低,溶液的PH 值逐渐增大,当达到c点时,硫酸和氢氧化钡恰好反应生成硫酸钡和水,溶液的pH=7,继续滴加氢氧化钡溶液,溶液的pH>7,故B正确;
C、c处,硫酸和氢氧化钡恰好反应生成硫酸钡和水,溶液呈中性;d处氢氧化钡溶液过量导致溶液呈碱性,故C错误;
D、硫酸和氢氧化钡的反应方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O,溶液混合前硫酸的物质的量浓度和氢氧化钡的物质的量浓度相同,根据图象知,滴加氢氧化钡溶液20mL时,两种溶液恰好反应,所以硫酸的体积为20mL,b点时,氢离子的物质的量浓度=
| 0.1mol/L×2×0.01L |
| 0.02L+0.01L |
| 1 |
| 15 |
| 0.1mol/L×2×0.01L |
| 0.02L+0.03L |
| 1 |
| 25 |
故选B.
点评:本题考查离子反应、化学计算、图象分析等,难度较大,理清离子反应的过程,确定沉淀的量与与Ba(OH)2溶液体积关系是关键,是对学生综合能力的考查.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
某氮肥厂氨氮废水中的氮元素多以NH4+ 和NH3?H2O的形式存在,经先期处理得到含HNO3的废水.一定条件下,向处理后的废水中加入CH3OH,将HNO3还原为N2.若该反应消耗32gCH3OH 转移6mol 电子,则下列说法正确的是( )
| A、硝酸分子中所有原子均达8电子结构 | B、参加反应的还原剂与氧化剂的物质的量之比为5:6 | C、常温下,向0.1mol/LNH3?H2O中加水稀释,则c(NH4+)/c(NH3?H2O) 将减小 | D、NH3分子与CO32-离子的空间构型相同 |
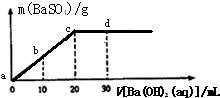 常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是( )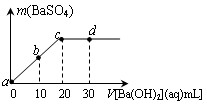 常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的( )