题目内容
【题目】如图为以惰性电极进行电解的装置: 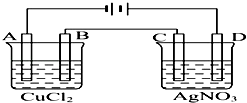
(1)写出A、B、C、D各电极上的电极反应式和总反应方程式: A: , B: , 总反应方程式:;
C: , D: , 总反应方程式: .
(2)在A、B、C、D各电极上析出生成物的物质的量之比为 .
(3)A极发生反应,B极发生反应.(填“氧化”或是“还原”)
【答案】
(1)Cu2++2e﹣═Cu;2Cl﹣﹣2e﹣═Cl2↑;CuCl2![]() Cu+Cl2↑;2Ag++2e﹣═2Ag;4OH﹣﹣4e﹣═2H2O+O2↑;4AgNO3+2H2O
Cu+Cl2↑;2Ag++2e﹣═2Ag;4OH﹣﹣4e﹣═2H2O+O2↑;4AgNO3+2H2O ![]() 4Ag+4HNO3+O2↑
4Ag+4HNO3+O2↑
(2)2:2:4:1
(3)还原;氧化
【解析】解:(1)该装置中AC是阴极、BD是阳极,A电极上铜离子放电生成Cu、B电极上氯离子放电生成氯气,所以相当于电解氯化铜生成Cu和氯气,所以A、B、电池反应式分别为Cu2++2e﹣═Cu、2Cl﹣﹣2e﹣═Cl2↑、CuCl2 ![]() Cu+Cl2↑;C电极上银离子放电生成Ag,D电极上氢氧根离子放电生成氧气和水,所以该电池中相当于电解硝酸银和水生成Ag、硝酸和氧气,所以C、D、电池反应式分别为2Ag++2e﹣═2Ag、4OH﹣﹣4e﹣═2H2O+O2↑、4AgNO3+2H2O
Cu+Cl2↑;C电极上银离子放电生成Ag,D电极上氢氧根离子放电生成氧气和水,所以该电池中相当于电解硝酸银和水生成Ag、硝酸和氧气,所以C、D、电池反应式分别为2Ag++2e﹣═2Ag、4OH﹣﹣4e﹣═2H2O+O2↑、4AgNO3+2H2O ![]() 4Ag+4HNO3+O2↑;
4Ag+4HNO3+O2↑;
所以答案是:Cu2++2e﹣═Cu;2Cl﹣﹣2e﹣═Cl2↑;CuCl2 ![]() Cu+Cl2↑;2Ag++2e﹣═2Ag;4OH﹣﹣4e﹣═2H2O+O2↑;4AgNO3+2H2O
Cu+Cl2↑;2Ag++2e﹣═2Ag;4OH﹣﹣4e﹣═2H2O+O2↑;4AgNO3+2H2O ![]() 4Ag+4HNO3+O2↑;(2)A、B、C、D电极反应式分别为Cu2++2e﹣═Cu、2Cl﹣﹣2e﹣═Cl2↑、2Ag++2e﹣═2Ag、4OH﹣﹣4e﹣═2H2O+O2↑,当都转移2mol电子时,A、B、C、D电极上生成的物质物质的量分别是1mol、1mol、2mol、0.5mol,其物质的量之比=1mol:1mol:2mol:0.5mol=2:2:4:1,
4Ag+4HNO3+O2↑;(2)A、B、C、D电极反应式分别为Cu2++2e﹣═Cu、2Cl﹣﹣2e﹣═Cl2↑、2Ag++2e﹣═2Ag、4OH﹣﹣4e﹣═2H2O+O2↑,当都转移2mol电子时,A、B、C、D电极上生成的物质物质的量分别是1mol、1mol、2mol、0.5mol,其物质的量之比=1mol:1mol:2mol:0.5mol=2:2:4:1,
所以答案是:2:2:4:1;(3)A电极上得电子发生还原反应,被还原,B电极上失电子发生氧化反应,被氧化,
所以答案是:还原;氧化.