题目内容
【题目】肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题 
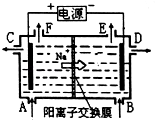
(1)肼燃料电池原理如图所示,N2H4通入的一极应为电池的极(填“正”或“负”).
(2)火箭常用N2O4作氧化剂,肼作燃料,已知: N2(g)+2O2(g)═2NO2(g)△H=﹣67.7kJmol﹣1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534.0kJmol﹣1
2NO2(g)N2O4(g)△H=﹣52.7kJmol﹣1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式 .
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可用尿素[CO(NH2)2]和次氯酸钠﹣氢氧化钠溶液反应获得,请写出尿素法反应的离子方程式为 .
【答案】
(1)负
(2)2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=﹣947.6kJ?mol﹣1
(3)CO(NH2)2+ClO﹣+2OH﹣=N2H4+CO32﹣+Cl﹣+H2O
【解析】解:(1)燃料电池中负极发生氧化反应,正极发生还原反应,依据图中装置可知,肼在反应中失去电子生成氮气发生氧化反应,所以N2H4通入的一极应为电池的负极,通入氧气的一极为正极;
所以答案是:负;(2)由N2(g)+2O2(g)=2NO2(g)△H=﹣67.7kJmol﹣1①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534.0kJmol﹣1 ②
2NO2(g)N2O4(g)△H=﹣52.7kJmol﹣1 ③根据盖斯定律可知②×2﹣①﹣③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),△H=(﹣534.0kJmol﹣1)×2﹣(﹣67.7kJmol﹣1)﹣(﹣52.7kJmol﹣1)=﹣947.6 kJmol﹣1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=﹣947.6 kJmol﹣1,所以答案是:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=﹣947.6 kJmol﹣1;(3)由在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,根据质量守恒定律可知两种盐为氯化钠和碳酸钠,该反应为CO(NH2)2+ClO﹣+2OH﹣=N2H4+CO32﹣+Cl﹣+H2O,
所以答案是:CO(NH2)2+ClO﹣+2OH﹣=N2H4+CO32﹣+Cl﹣+H2O;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】某化学小组准备用环己醇制备环己烯,查得相关资料如下.反应原理:  反应物与产物的物理性质:
反应物与产物的物理性质:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)实验过程中可能发生的有机副反应的方程式为 .
(2)根据上述资料,装置(A,B,C)最适宜用来完成本次制备实验. 
(3)制备粗产品 将5mL加入试管A中,再加入10m , 摇匀后放入碎瓷片,缓慢加热至反应完全.
(4)粗产品提纯 ①环己烯粗产品中含有环己醇和少量酸性杂质等.粗产品需依次经过水洗、加碳酸钠溶液洗涤以及第二次水洗.在此过程中加入碳酸钠溶液的目的是;分液时,环己烯应从分液漏斗的(填“上”或“下”)口取出.
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入图D所示装置的(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 .