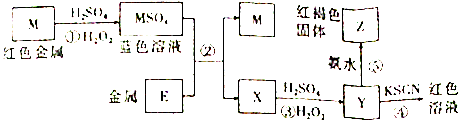
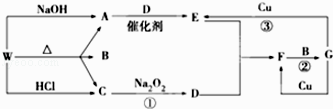
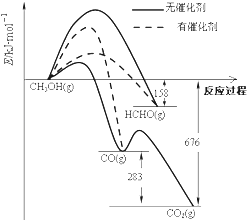
��Ŀ����
����Ŀ�������£���100mL0.1mol/LNH4HSO4��Һ�еμ�0.1mol/L��NaOH��Һ��������ҺPH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ������˵����ȷ���ǣ������� 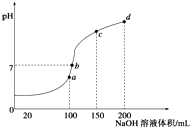
A.a��b��c��d�ĸ����У�ˮ�ĵ���̶�������d
B.a����Һ�У�c��NH3H2O��+c��H+���Tc��OH����
C.b����Һ�У�c��Na+��+c��NH4+���T2c��SO42����
D.c����Һ�У�c��Na+���Tc��SO42����+c��NH4+��+c��NH3H2O��
���𰸡�C
���������⣺a��b��c��d�ĸ��㣬���ݷ�Ӧ���Ĺ�ϵ��a��ǡ��������H+����Һ��ֻ�У�NH4��2SO4��Na2SO4��b��c��d������Һ������NH3H2O����NH4��2SO4���Դٽ�ˮ�ĵ��룬��NH3H2O����ˮ�ĵ��룮b����Һ�����ԣ�����Һ���У�NH4��2SO4��Na2SO4��NH3H2O���ֳɷ֣�
A��a��b��c��d�ĸ��㣬���ݷ�Ӧ���Ĺ�ϵ��a��ǡ��������H+����Һ��ֻ�У�NH4��2SO4��Na2SO4��b��c��d������Һ������NH3H2O����NH4��2SO4���Դٽ�ˮ�ĵ��룬��NH3H2O����ˮ�ĵ��룮b����Һ�����ԣ�����a��ˮ�ĵ���̶����A����
B��a��ǡ��������H+����Һ��ֻ�У�NH4��2SO4��Na2SO4����Һ�����ԣ�c��H+����c��OH��������B����
C��b����ҺΪ���ԣ���Һ��c��OH����=c��H+������ϵ���غ��֪��c��NH4+��+c��Na+��+c��H+��=2c��SO42����+c��OH��������c��Na+��+c��NH4+��=2c��SO42��������C��ȷ��
D��c���������Ƶ����Ϊ150mL������3[n��N����+n��S��]=4n��Na��������3c��NH4+��+3c��NH3H2O��+3c��SO42����=4c��Na+������D����ѡC��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�