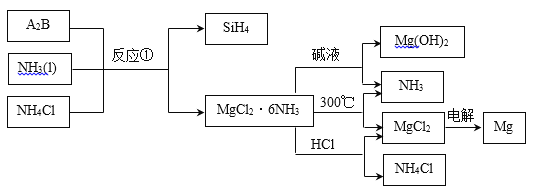
题目内容
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)写出下列元素的名称:A_____,B_____,C_____,D_____。
(2)D元素位于周期表中____周期_____族。D2-的结构示意图是____。
(3)AB2是___(填“共价”或“离子”)化合物,C2B2所含化学键的类型是___、___。写出AB2与C2B2反应的化学方程式:___________________。
(4)用电子式表示化合物C2D的形成过程:________。
【答案】碳 氧 钠 硫 三 ⅥA ![]() 共价 离子键 非极性共价键 2CO2+2Na2O2=2Na2CO3+O2
共价 离子键 非极性共价键 2CO2+2Na2O2=2Na2CO3+O2 ![]()
【解析】
A和B具有相同的电子层数,即A和B位于同周期,A的L层电子数是K层电子数的两倍,即A为C,C在空气中燃烧时呈现黄色火焰,即C为Na,Na在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,即B为O,D为S。
(1) A和B具有相同的电子层数,即A和B位于同周期,A的L层电子数是K层电子数的两倍,即A为C,C在空气中燃烧时呈现黄色火焰,即C为Na,Na在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,即B为O,D为S;
(2)D为S,位于第三周期VIA族;S2-的结构示意图为![]() ;
;
(3)AB2化学式为CO2,CO2属于共价化合物;C2B2的化学式为Na2O2,其电子式为![]() ,含有离子键、(非极性)共价键;CO2与Na2O2反应:2Na2O2+2CO2=2Na2CO3+O2;
,含有离子键、(非极性)共价键;CO2与Na2O2反应:2Na2O2+2CO2=2Na2CO3+O2;
(4)C2D的化学式为Na2S,属于离子化合物,即用电子式表示化合物形成过程:![]() 。
。

 一线名师提优试卷系列答案
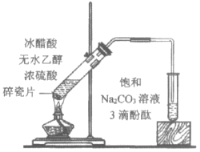
一线名师提优试卷系列答案【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
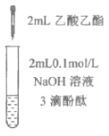
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
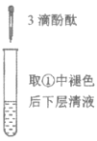
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)