题目内容
13.下列离子方程式正确的是( )| A. | 过量的SO2通入氨水中:SO2+2NH3•H2O═2 NH4++SO32-+H2O | |
| B. | SO2通入溴水中:Br2+SO2+2H2O═2H++SO42-+2HBr | |
| C. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 酸雨久置pH变小:2H2SO3+O2═4H++2 SO42- |
分析 A.反应生成亚硫酸氢铵;
B.发生氧化还原反应生成硫酸和HBr,HBr为强酸;
C.发生氧化还原反应生成硫酸钙;
D.反应生成硫酸,酸性增强.
解答 解:A.过量的SO2通入氨水中的离子反应为SO2+NH3•H2O═NH4++HSO3-,故A错误;
B.SO2通入溴水中的离子反应为Br2+SO2+2H2O═4H++SO42-+2Br-,故B错误;
C.少量SO2通入漂白粉溶液中的离子反应为SO2+Ca2++2ClO-+H2O=CaSO4↓+H++Cl-+HClO,故C错误;
D.酸雨久置pH变小的离子反应为2H2SO3+O2═4H++2SO42-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
1.下列有关化学用语表示正确的是( )
| A. | 二氧化硅的分子式:SiO2 | |
| B. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{78}$I | |
| C. | 甲基的电子式: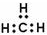 | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO${\;}_{4}^{2-}$ |
8.某溶液中含有NH4+、Fe2+、Fe3+、Al3+四种离子,若向溶液中先滴加过量的NaOH溶液,然后再滴加过量的稀盐酸,则溶液中离子数目保持不变的是( )
| A. | Al3+ | B. | NH4+ | C. | Fe3+ | D. | Fe2+ |
18.提纯含有少量Ba(NO3)2杂质的KNO3溶液,可使用的方法为( )
| A. | 加入过量Na2CO3溶液、过滤、除去沉淀,溶液中补加适量硝酸 | |
| B. | 加入过量K2SO4溶液、过滤、除去沉淀,溶液中补加适量硝酸 | |
| C. | 加入过量K2CO3溶液、过滤、除去沉淀,溶液中补加适量盐酸 | |
| D. | 加入过量K2CO3溶液、过滤、除去沉淀,溶液中补加适量硝酸 |
5.以下操作或实验装置不能用于分离物质的是( )
| A. | 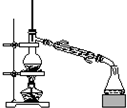 | B. |  | C. | 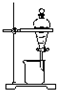 | D. | 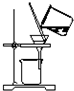 |
14.下列各项中,各微粒的浓度关系一定正确的是( )
| A. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)>c(OH-) | |
| B. | 1.0 mol•L-1 Na2CO3溶液:c(Na+)>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到PH=6的酸性溶液:c(CH3COO-)-c(Na+)=10-6 mol•L-1 | |
| D. | 物质的量浓度相等的①(NH4)2CO3、②(NH4)2Fe(SO4)2、③NH4HSO4溶液中c(NH${\;}_{4}^{+}$):②>①>③ |