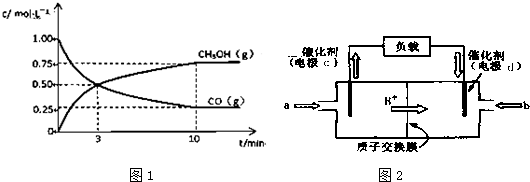
题目内容
14.下列各项中,各微粒的浓度关系一定正确的是( )| A. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)>c(OH-) | |
| B. | 1.0 mol•L-1 Na2CO3溶液:c(Na+)>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到PH=6的酸性溶液:c(CH3COO-)-c(Na+)=10-6 mol•L-1 | |
| D. | 物质的量浓度相等的①(NH4)2CO3、②(NH4)2Fe(SO4)2、③NH4HSO4溶液中c(NH${\;}_{4}^{+}$):②>①>③ |
分析 A.二元弱酸的酸式盐NaHA溶液的酸碱性取决于HA-的水解与电离程度大小;
B.碳酸钠溶液中,氢氧根离子来自碳酸根离子的水解和水的电离,则c(HCO3-)<c(OH-);
C.根据混合液中的电荷守恒判断;
D.物质的量浓度相等的铵盐溶液中,铵根离子的浓度与其化学式中铵根离子的系数及铵根离子的水解程度有关,铵根离子的系数越大、水解程度越小,则铵根离子的浓度越大.
解答 解:A.NaHA溶液的酸碱性取决于HA-的水解与电离程度,当HA-的水解大于其电离程度时,溶液显示碱性,则c(H+)<c(OH-),故A错误;
B.1.0 mol•L-1 Na2CO3溶液中,碳酸根离子部分水解,溶液呈碱性,由于氢氧根离子来自碳酸根离子的水解和水的电离,则c(HCO3-)<c(OH-),所以正确的离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故B错误;
C.向醋酸钠溶液中加入适量醋酸,得到pH=6的酸性溶液,该溶液中氢离子浓度为10-6mol•L-1,氢氧根离子浓度为10-8mol•L-1,根据电荷守恒可得:c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol•L-1-10-8mol•L-1=9.9×10-7mol•L-1,故C错误;
D.等温、等物质的量浓度的铵盐溶液中,①②中铵根离子浓度大于③,②中亚铁离子抑制铵根离子水解,所以②中铵根离子浓度大于①,所以这3种溶液中铵根离子浓度大小顺序:②>①>③,故D正确;
故选D.
点评 本题考查离子浓度大小的比较,题目难度中等,根据电荷守恒、盐类的水解及其影响等知识点来分析,试题充分考查了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
13.下列离子方程式正确的是( )
| A. | 过量的SO2通入氨水中:SO2+2NH3•H2O═2 NH4++SO32-+H2O | |
| B. | SO2通入溴水中:Br2+SO2+2H2O═2H++SO42-+2HBr | |
| C. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 酸雨久置pH变小:2H2SO3+O2═4H++2 SO42- |
5.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白.过氧化氢法生产亚氯酸钠的流程图如下:

已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O且NaClO2在碱性条件下稳定性较高.试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
(2)在NaClO2稳定装置中,H2O2作B(选填序号).
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是BEA(按实验先后顺序填写操作代号).
A.过滤 B.加热蒸发 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO2-能被I-完全还原成Cl-;溶液中Na2S2O3能与I2反应:2Na2S2O3+I2═2NaI+Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
①步骤Ⅱ中发生反应的离子方程式是ClO2-+4H++4I-=2I2+Cl-+2H2O,步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×1{0}^{-2}VC}{4W}$×100%(用字母表示).

已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O且NaClO2在碱性条件下稳定性较高.试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
(2)在NaClO2稳定装置中,H2O2作B(选填序号).
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是BEA(按实验先后顺序填写操作代号).
A.过滤 B.加热蒸发 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO2-能被I-完全还原成Cl-;溶液中Na2S2O3能与I2反应:2Na2S2O3+I2═2NaI+Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
②若上述滴定操作中用去了VmL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×1{0}^{-2}VC}{4W}$×100%(用字母表示).
9.根据元素周期表和元素周期律,判断下列有关描述正确的是( )
| A. | 碱金属元素中,金属活泼性最强的是Li | |
| B. | 第三周期元素中,原子半径最大的是Cl | |
| C. | 短周期元素最高价氧化物对应的水化物中,酸性最强的是H2SO4 | |
| D. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
19.由14CO和12CO组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是( )
| A. | 混合气体中14CO与12CO的分子数之比为14:15 | |
| B. | 混合气体中14CO与12CO的物质的量之比为1:1 | |
| C. | 混合气体中14CO与12CO的质量之比为14:15 | |
| D. | 混合气体中14CO与12CO的密度之比为1:1 |
6.火山爆发产生的气体中含有1%的羰基硫(化学式为COS,C═O就是羰基),已知羰基硫分子中所有原子最外层均满足8电子稳定结构,结合元素周期表知识,下列有关说法正确的是( )
| A. | 羰基硫中O为-2价,C、S都是+1价 | |
| B. | 羰基硫分子中共含有3个原子核、16个电子 | |
| C. | 羰基硫分子结构中只含有极性共价键 | |
| D. | 羰基硫的电子式为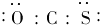 |
3.已知:5S2O82-+2Mn2++8H2O═2MnO4-+10SO42-+16X,对于该反应下列叙述不正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为2:5 | |
| B. | 该反应体系不能用盐酸酸化 | |
| C. | 若有0.1 mol还原剂被氧化,则转移电子0.5 mol | |
| D. | 若把该反应设计为原电池,则正极反应为S2O82--2e-═2SO42- |
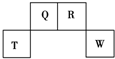 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等.请回答下列问题: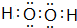 ,存在的化学键类型有非极性键和极性键.
,存在的化学键类型有非极性键和极性键.