题目内容
为减小和消除过量CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
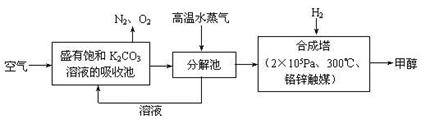
写出分解池中反应的化学方程式 。在合成塔中,当有4.4 kg CO2与足量H2
完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(2)以CO2为碳还可以制备乙醇,反应如下:
2CO2(g) + 6H2(g)= CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式 。
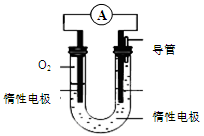
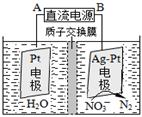
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
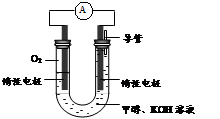
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。当电子转移 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)以甲醇为燃料还可制作新型燃料电池,电池的正极通入O2,负极通入甲醇,用熔融金属氧化物MO作电解质(可传导O2-)。该电池负极发生的电极反应是 ;放电时,O2-移向电池的 (填“正”或“负”)极。
(1)最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:

写出分解池中反应的化学方程式 。在合成塔中,当有4.4 kg CO2与足量H2
完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(2)以CO2为碳还可以制备乙醇,反应如下:
2CO2(g) + 6H2(g)= CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。当电子转移 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)以甲醇为燃料还可制作新型燃料电池,电池的正极通入O2,负极通入甲醇,用熔融金属氧化物MO作电解质(可传导O2-)。该电池负极发生的电极反应是 ;放电时,O2-移向电池的 (填“正”或“负”)极。
(1)2KHCO3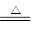 K2CO3+H2O+CO2↑(2分)
K2CO3+H2O+CO2↑(2分)
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.47kJ/mol(2分)
(2)2CH3OH(g) =CH3CH2OH(g)+ H2O(g) △H=-74.66kJ/mol(2分)
(3)① O2 + 2H2O + 4e-= 4OH- (2分)
②2CH3OH + 3O2 + 4OH-= 2CO32- + 6H2O (2分) ; 1.2mol(2分)
(4)CH3OH-6e-+3O2-= CO2+2H2O(2分) 负(1分)
 K2CO3+H2O+CO2↑(2分)
K2CO3+H2O+CO2↑(2分)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.47kJ/mol(2分)
(2)2CH3OH(g) =CH3CH2OH(g)+ H2O(g) △H=-74.66kJ/mol(2分)
(3)① O2 + 2H2O + 4e-= 4OH- (2分)
②2CH3OH + 3O2 + 4OH-= 2CO32- + 6H2O (2分) ; 1.2mol(2分)
(4)CH3OH-6e-+3O2-= CO2+2H2O(2分) 负(1分)
试题分析:(1)分解池中反应的化学方程式2KHCO3
 K2CO3+H2O+CO2↑。根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,所以热化学方程式为CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣49.47kJ/mol;(2)2CO2(g) + 6H2(g)= CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol,根据盖斯定律,对(1)中方程式乘以2然后用该方程式减去(1),可以得到CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式2CH3OH(g) =CH3CH2OH(g)+ H2O(g) △H=-74.66kJ/mol。(3)氧气在正极上被还原,在碱性条件下生成水,电池正极电极反应式为 O2 + 2H2O + 4e-= 4OH- ,电池的正极上有聚集的电子,放电时,电解质溶液的阳离子向电池的正极移动,即H+移向电池的正极。②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 2CH3OH + 3O2 + 4OH-= 2CO32- + 6H2O 。参加反应的氧气的体积是6.72L(标准状况下),物质的量是0.3mol,转移电子物质的量为1.2mol。(4)甲醇在负极失去电子,该电池负极发生的电极反应是CH3OH-6e-+3O2-= CO2+2H2O;放电时,O2-移向电池的负极。2创新利用的研究为载体,考查热化学方程式、原电池,难度中等,旨在考查学生对知识的掌握及迁移运用能力。
K2CO3+H2O+CO2↑。根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,所以热化学方程式为CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=﹣49.47kJ/mol;(2)2CO2(g) + 6H2(g)= CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol,根据盖斯定律,对(1)中方程式乘以2然后用该方程式减去(1),可以得到CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式2CH3OH(g) =CH3CH2OH(g)+ H2O(g) △H=-74.66kJ/mol。(3)氧气在正极上被还原,在碱性条件下生成水,电池正极电极反应式为 O2 + 2H2O + 4e-= 4OH- ,电池的正极上有聚集的电子,放电时,电解质溶液的阳离子向电池的正极移动,即H+移向电池的正极。②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 2CH3OH + 3O2 + 4OH-= 2CO32- + 6H2O 。参加反应的氧气的体积是6.72L(标准状况下),物质的量是0.3mol,转移电子物质的量为1.2mol。(4)甲醇在负极失去电子,该电池负极发生的电极反应是CH3OH-6e-+3O2-= CO2+2H2O;放电时,O2-移向电池的负极。2创新利用的研究为载体,考查热化学方程式、原电池,难度中等,旨在考查学生对知识的掌握及迁移运用能力。
练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
 2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。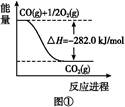


 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol  2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。
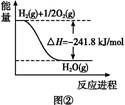
 O2(g)=H2O(1) △H2=-285.8 kJ/mol
O2(g)=H2O(1) △H2=-285.8 kJ/mol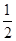 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
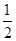 O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2 CH3OH(g) ΔH1
CH3OH(g) ΔH1