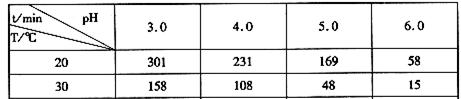
题目内容
下列各组变化中,ΔH或Q前者小于后者的一组是( )。
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)=2H2O(l) ΔH1
H2(g)+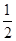 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)=2H2O(l) ΔH1
H2(g)+
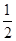 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
| A.①②③ | B.②④ | C.②③④ | D.③④ |
A
①中生成液态水放出的热量多,但ΔH为负值,所以ΔH1<ΔH2;②中ΔH1=2ΔH2<0;③中恒压条件下反应进行的程度大,放出的热量多;④中ΔH1>0,ΔH2<0。

练习册系列答案
相关题目
 2CO(g) ΔH="-221.0" kJ·mol-1
2CO(g) ΔH="-221.0" kJ·mol-1 O2(g)
O2(g) H2O(l)ΔH="-285.8" kJ/mol
H2O(l)ΔH="-285.8" kJ/mol CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。  O2 (g)
O2 (g) CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol
CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol  H2 O(g) ?H2= —120.9kJ/mol
H2 O(g) ?H2= —120.9kJ/mol 
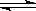 2B(g)在前110 s内的反应进程。
2B(g)在前110 s内的反应进程。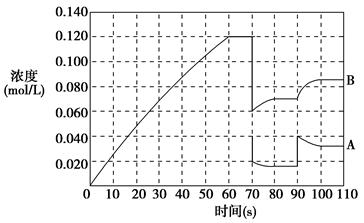

 CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
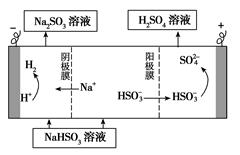

 H++CN-电离的ΔH为 kJ·mol-1
H++CN-电离的ΔH为 kJ·mol-1