题目内容
8.在水溶液中能够大量共存的是( )| A. | Na+、Fe2+、OH- | B. | Ag+、Cl-、NO3- | C. | NH4+、OH-、SO42- | D. | Na+、Cl-、NO3- |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,则离子大量共存,以此来解答.
解答 解:A.Fe2+、OH-结合生成沉淀,不能大量共存,故A错误;
B.Ag+、Cl-结合生成沉淀,不能大量共存,故B错误;
C.NH4+、OH-结合生成弱电解质,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
18.下列反应最终无沉淀产生的是( )
①过量的CO2通入Na2SiO3溶液中 ②向氢氧化铝溶液中滴加氢氧化钠溶液至过量
③少量的SO2通入BaCl2溶液中 ④向MgCl2溶液中滴加NaOH溶液至过量.
①过量的CO2通入Na2SiO3溶液中 ②向氢氧化铝溶液中滴加氢氧化钠溶液至过量
③少量的SO2通入BaCl2溶液中 ④向MgCl2溶液中滴加NaOH溶液至过量.
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
19.CoCl2•xH2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
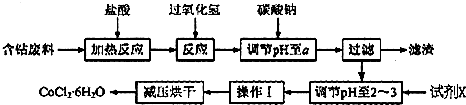
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl═CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;
(3)最合适的试剂X是盐酸
(4)操作I包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和减压过滤.
(5)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl═CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Co(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;
(3)最合适的试剂X是盐酸
(4)操作I包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和减压过滤.
(5)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
16.标准状况下质量为4g H2的体积约为( )
| A. | 11.2 L | B. | 22.4 L | C. | 33.6 L | D. | 44.8 L |
13.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 钠与水的反应:2Na+2H2O═2Na++OH-+H2↑ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
20.有机化合物M的结构简式如图所示,有关化合物M的叙述正确的是( )
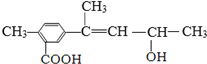
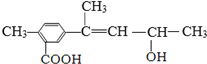
| A. | M的分子式为C13H18O3 | |
| B. | M一定条件下,可以发生加成、酯化、水解等反应 | |
| C. | 1mol M与足量金属钠反应,可生成标准状况下的H211.2 L | |
| D. | 1mol M最多能与4mol H2发生加成反应 |
17.在容积一定的密闭窗口中,反应A?B(g)+C(s)达平衡,若继续升高温度,容器内气体的密度增大,下列判断正确的是( )
| A. | 压强对该反应的平衡移动没有影响 | |
| B. | 在平衡体系中加入C,混合气体平均分子量增大 | |
| C. | 若正反应为吸热反应,则A为非气态 | |
| D. | 若正反应为放热反应,则A为非气态 |
 与Br2发生加成反应,生成的产物中可能含有下列的( )
与Br2发生加成反应,生成的产物中可能含有下列的( )