题目内容
【题目】将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A. 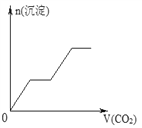 B.
B. 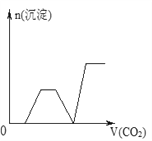
C. 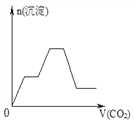 D.
D. 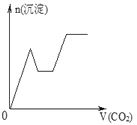
【答案】C
【解析】试题分析:通入CO2,立刻就有沉淀BaCO3产生:CO2+Ba(OH)2=BaCO3↓+H2O,将Ba(OH)2消耗完后,接下来消耗NaOH:CO2+2NaOH=Na2CO3+H2O,因而此段不会产生沉淀(即沉淀的量保持不变),NaOH被消耗完后,接下来二氧化碳又与NaAlO2反应产生沉淀,沉淀的量继续增加,CO2+3H2O+2NaAlO2=2Al(OH)3↓+Na2CO3,当NaAlO2消耗完时产生最大量的沉淀,继续通入CO2,与上面反应的产物Na2CO3反应生成碳酸氢钡,然后与BaCO3反应生成碳酸氢钡,此时沉淀开始溶解,最后剩余沉淀为Al(OH)3,反应的离子方程式分别是CO2+H2O+Na2CO3=2NaHCO3、BaCO3+CO2+H2O=Ba(HCO3)2,答案选C。

【题目】下列说法中正确的是
A. 摩尔是国际科学界建议采用的一种物理量
B. 摩尔是物质的量的单位,简称摩,符号为mol
C. 摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D. 氢氧化钠的摩尔质量是40
【题目】某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2的电子式为___________。它与水反应的离子方程式是__________________。
(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂___________(填化学式),有气体产生。
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/L KMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mL KMnO4溶液。
①实验中,滴定时KMnO4溶液应装在__________(酸或碱)式滴定管中。
②用单线桥标出该反应电子转移的方向和数目:_______________。
2MnO4-+5H2O2+6H+ = 2Mn2++5O2↑+8H2O。
③溶液a中 c(H2O2)=___________ mol/L。

