题目内容
【题目】根据已学知识,回答下列问题。
(1)已知下列元素基态原子的电子排布式,判断它们所在的周期和族。
①![]() ___________________ ;
___________________ ;
②![]() ___________________ ;
___________________ ;
③![]() ___________________ ;
___________________ ;
④![]() ___________________ 。
___________________ 。
(2)已知下列元素在周期表中的位置,写出它们的元素符号和价电子排布式。
①第4周期IVB族____________、____________;
②第5周期VIIA族____________、____________。
【答案】第3周期ⅢA族 第4周期ⅥB族 第4周期Ⅷ族 第6周期ⅣA族 Ti 3d24s2 I 5s25p5
【解析】
(1)由电子排布式中的能层序数判断所在的周期,由外围电子数判断所在的族;
(2)结合前36号元素和主族元素的元素符号和价电子排布解答。
(1)①电子排布式为![]() 的为铝元素,位于第3周期ⅢA族,故答案为:第3周期ⅢA族;
的为铝元素,位于第3周期ⅢA族,故答案为:第3周期ⅢA族;
②电子排布式为![]() 的为Cr元素,位于第4周期ⅥB族,故答案为:第4周期ⅥB族;
的为Cr元素,位于第4周期ⅥB族,故答案为:第4周期ⅥB族;
③电子排布式为![]() 的为Fe元素,位于第4周期Ⅷ族,故答案为:第4周期Ⅷ族;
的为Fe元素,位于第4周期Ⅷ族,故答案为:第4周期Ⅷ族;
④电子排布式为![]() ,最高能层为第6层,最外层为4个电子,位置为:第6周期ⅣA族,故答案为:第6周期ⅣA族;
,最高能层为第6层,最外层为4个电子,位置为:第6周期ⅣA族,故答案为:第6周期ⅣA族;
(2)①第4周期IVB族的元素为Ti,价电子排布式为:3d24s2,故答案为:Ti;3d24s2;
②第5周期VIIA族为I,价电子排布式为5s25p5,故答案为:I;5s25p5。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案【题目】碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
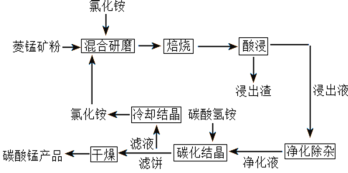
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下,Ksp(CaF2)=1.46×1010,Ksp(MgF2)=7.42×1011;Ka(HF)=1.00×104
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
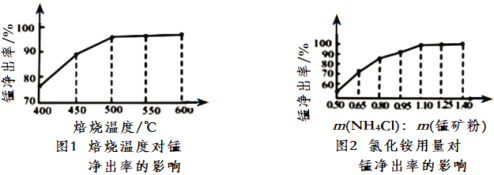
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________
(4)净化除杂流程如下
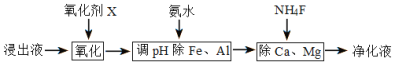
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A. (NH4)2S2O8 B. MnO2 C. KMnO4
②调节pH时,pH可取的范围为_________________
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中,![]() =______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
=______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________