题目内容
【题目】按要求填空。
(1)在Fe、Fe2+、Fe3+、H+中,
①只有氧化性的是______________________________;
②只有还原性的是______________________________;
③既有氧化性又有还原性的是____________________。
(2)已知Rx![]() +
+![]() +H+―→RO2+Mn2++H2O变化过程中,0.2 mol Rx
+H+―→RO2+Mn2++H2O变化过程中,0.2 mol Rx![]() 参加反应,共转移0.4 mol电子。
参加反应,共转移0.4 mol电子。
①反应中的被还原的微粒是________。
②x=________。
③参加反应的氢离子的物质的量为________。
【答案】Fe3+、H+ Fe Fe2+ ![]() 2 0.64mol
2 0.64mol
【解析】
(1)最高价态的元素只有氧化性,最低价态的元素只有还原性,中间价态的元素既有氧化性又有还原性,据此分析解答;
(2)RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,R元素化合价由+![]() 价升高到+4价,Mn元素化合价由+7价降低到+2价,结合氧化还原反应中氧化剂和还原剂之间得失电子数目相等解答该题。
价升高到+4价,Mn元素化合价由+7价降低到+2价,结合氧化还原反应中氧化剂和还原剂之间得失电子数目相等解答该题。
(1)Fe3+、H+中的化合价都是最高价态,所以都只有氧化性;Fe中的化合价是最低价态,所以只有还原性;Fe2+中的化合价是中间价态,所以既有氧化性又有还原性;
(2)①反应中Mn元素的化合价从+7价降为+2价,则被还原的微粒是![]() ;
;
②0.2molRxO42- 参加反应,共转移0.4mol 电子,则0.2mol×x×(4-![]() )=0.4mol,解得:x=2;
)=0.4mol,解得:x=2;
③根据电子守恒配平后的化学方程式为5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O,当消耗5moR2O42-时,需要氢离子的物质的量是16mol,所以0.2 mol R2O42-参加反应时,反应的H+的物质的量为0.64mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下图是实验室制氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
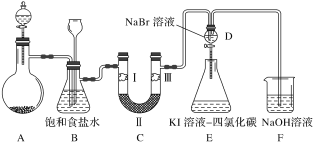
(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为:_____。
(2)装置B中饱和食盐水的作用是___________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次放入_____。(填字母)
a | b | c | d | |
Ⅰ | 干燥的 有色布条 | 湿润的 有色布条 | 湿润的 有色布条 | 干燥的 有色布条 |
Ⅱ | 碱石灰 | 无水CaCl2 | 浓硫酸 | 无水CaCl2 |
Ⅲ | 湿润的 有色布条 | 干燥的 有色布条 | 干燥的 有色布条 | 湿润的 有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙黄色,打开D装置中活塞,将D中少量溶液加入装置E中,振荡。观察到的现象是_________。经认真考虑,有同学提出该实验方案仍有不足,请说明其中原因___________。
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的化学方程式:______。