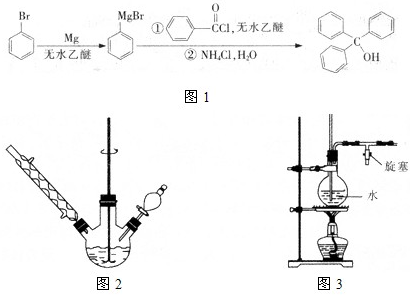
题目内容
甲醇是一种重要的可再生能源,工业上可用CO和H2合成。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图。

根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K= ;
升高温度,K值 (填“增大”、“减小”
或“不变”)。
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2) = 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是: (写出相关的化学方程式并辅以必要的文字说明)。
(1)2H2(g)+O2(g) =2H2O(l)(只要写对反应式即给1分。没配平扣1分,没标明状态扣1分,若二者都存在只扣1分。)
(2)① ;
减小。②0.2mol·L—1·s—1(没有单位或错扣1分)。③bc(各1分。填错一个倒扣1分,不出现负分。)。
;
减小。②0.2mol·L—1·s—1(没有单位或错扣1分)。③bc(各1分。填错一个倒扣1分,不出现负分。)。
④Cu2O+CO 2Cu+CO2,体系中有CO2可以抑制Cu2O被还原。(3分。化学方程式给1分,文字说明給2分。若化学方程式用可逆号,文字说明只要从化学平衡角度回答都给分。若说明CO2与Cu反应生成Cu2O也给分。)
2Cu+CO2,体系中有CO2可以抑制Cu2O被还原。(3分。化学方程式给1分,文字说明給2分。若化学方程式用可逆号,文字说明只要从化学平衡角度回答都给分。若说明CO2与Cu反应生成Cu2O也给分。)
【解析】
试题分析:(1)所求反应中有H2存在,CO2和H2O都是中间产物,结合盖斯定律,可推得还需要的反应为2H2(g)+O2(g) =2H2O(l)的焓变;
(2)①根据反应 ,其平衡常数表达式
,其平衡常数表达式 ,结合图像,可知升高温度,甲醇含量降低,平衡向逆反应方向移动,说明该反应是放热反应,故升高温度,K值减小;
,结合图像,可知升高温度,甲醇含量降低,平衡向逆反应方向移动,说明该反应是放热反应,故升高温度,K值减小;
②在500℃,从反应开始到平衡,甲醇增加了0.4 mol,H2消耗了0.8 mol,则氢气的平均反应速率v(H2)=  =0.2 mol·L—1·s—1;
=0.2 mol·L—1·s—1;
③Z点处于平衡状态,将体积压缩至原来的1/2,相当于加压了,平衡正向移动,依次进行解答;
a、各物质的浓度均比原来增大了,错误;
b、浓度增大导致正、逆反应速率都加快,正确;
c、因平衡正向移动,甲醇的物质的量增加,正确;
d、因平衡正向移动,氢气减少,甲醇增加,所以n(H2) /n(CH3OH)将减小,错误;
④二氧化碳有利于抑制反应 Cu2O+CO 2Cu+CO2向正反应方向移动,维持Cu2O的量不变,。
2Cu+CO2向正反应方向移动,维持Cu2O的量不变,。
考点:考查盖斯定律,化学平衡常数,化学平衡移动影响因素。

 名校课堂系列答案
名校课堂系列答案甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+ H2O (g)  CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。?
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。?
时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
①已知:CH3OH (g)+  O2 (g)
O2 (g)  CO2(g) + 2H2 (g)? ?H1= —192.9kJ/mol?
CO2(g) + 2H2 (g)? ?H1= —192.9kJ/mol?
H2(g)+  O2 (g)
O2 (g)  H2 O(g)? ?H2= —120.9kJ/mol?
H2 O(g)? ?H2= —120.9kJ/mol?
则甲醇与水蒸气催化重整反应的焓变△H3=_____??????????????????? 。?
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。?
③该反应的平衡常数表达式为K=__________________。?
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。?
A.加入催化剂?????????????? B.恒容充入He(g),使体系压强增大?
C.将H2(g)从体系中分离??? D.再充入1molH2O?
(2)甲醇在催化剂条件下可以直接氧化成甲酸。?
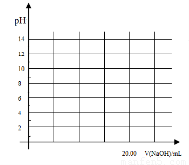
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。?
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL)?
 CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1
 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1= CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为