题目内容
甲醇是一种很好的燃料,被称为21世纪的新型燃料.
工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:
CO(g)+2H2(g) CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1
(1)已知:CO(g)+
O2(g)=CO2(g)△H2=-283kJ?molˉ1
H2(g)+
O2(g)=H2O (g)△H3=-242kJ?molˉ1
1mol甲醇燃烧生成CO2和水蒸气放出
(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下在VL容器中制备甲醇.
①若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
A.则上表中剩余的实验条件数据:a=
B.根据反应特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变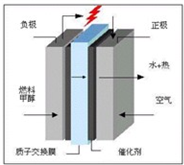 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1=
③100℃时,CH3OH(g) CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为
(用含a、V的代数式表示).
(3)科学家预言,燃料电池将是21世纪获得电力的重要途径,而甲醇燃料电池具备甲醇燃料容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源.右图是甲醇的质子交换膜型燃料电池模型.写出其电极反应式
正极:
负极:
工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)
 CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1(1)已知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
1mol甲醇燃烧生成CO2和水蒸气放出
651
651
kJ的热量.(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下在VL容器中制备甲醇.
①若容器容积不变,下列措施可增加甲醇产率的是
BD
BD
.A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.

| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
150
150
、b=1/3
1/3
.B.根据反应特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变
 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1=0.1
0.1
MPa.③100℃时,CH3OH(g)
 CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为| 4a2 |
| V2 |
| 4a2 |
| V2 |
(用含a、V的代数式表示).
(3)科学家预言,燃料电池将是21世纪获得电力的重要途径,而甲醇燃料电池具备甲醇燃料容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源.右图是甲醇的质子交换膜型燃料电池模型.写出其电极反应式
正极:
3O2+12e-+12H+→6H2O
3O2+12e-+12H+→6H2O
负极:
2CH4O-12e-+2H2O→12H++2CO2
2CH4O-12e-+2H2O→12H++2CO2
.分析:(1)根据已知反应和目标反应,利用盖斯定律来计算反应热;
(2)①反应CO(g)+2H2(g) CH3OH(g)向正向移动,则可增加甲醇产率;
CH3OH(g)向正向移动,则可增加甲醇产率;
②由图可知,横坐标为温度,纵坐标为CO的转化率,P1、P2为两种不同的压强,以此来分析实验数据;
③化学平衡常数为生成物浓度幂之积与反应物浓度幂之积的比;
(3)由甲醇的质子交换膜型燃料电池模型图可知,负极甲醇参与反应,正极氧气参与反应,且H+能通过交换膜,以此来书写电极反应式.
(2)①反应CO(g)+2H2(g)
 CH3OH(g)向正向移动,则可增加甲醇产率;
CH3OH(g)向正向移动,则可增加甲醇产率;②由图可知,横坐标为温度,纵坐标为CO的转化率,P1、P2为两种不同的压强,以此来分析实验数据;
③化学平衡常数为生成物浓度幂之积与反应物浓度幂之积的比;
(3)由甲醇的质子交换膜型燃料电池模型图可知,负极甲醇参与反应,正极氧气参与反应,且H+能通过交换膜,以此来书写电极反应式.
解答:解:(1)由①CO(g)+2H2(g)  CH3OH(g)△H1=-116kJ?mol-1,
CH3OH(g)△H1=-116kJ?mol-1,
②CO(g)+
O2(g)=CO2(g)△H2=-283kJ?mol-1,
③H2(g)+
O2(g)=H2O (g)△H3=-242kJ?mol-1,
根据盖斯定律可知,②+③×2-①可得CH3OH(g)+
O2(g)=CO2(g)+2H2O (g),
则△H=(-283kJ?mol-1)+(-242kJ?mol-1)×2-(-116kJ?mol-1)=-651kJ?mol-1,
即1mol甲醇燃烧生成CO2和水蒸气放出651kJ的热量,故答案为:651;
(2)①对于CO+2H2 CH3OH,为放热反应,
CH3OH,为放热反应,
A.升高温度,化学平衡逆向移动,则甲醇的产率降低,故A错误;
B.将CH3OH(g)从体系中分离,能使反应正向移动,甲醇的产率增大,故B正确;
C.充入He,使体系总压强增大,容积不变,则反应体系中各物质的浓度不变,化学平衡不移动,产率不变,故C错误;
D.再充入1molCO和3molH2,反应物的浓度增大,反应正向移动,甲醇的产率增大,故D正确;
故答案为:BD;
②A.因图中横坐标为温度,纵坐标为CO的转化率,P1、P2为两种不同的压强,则实验中n(CO)/n(H2)相同,即b=1/3,为便于比较,则实验1和实验2的温度应相同,压强不同,即a=150,故答案为;150;1/3;
B.由图可知,相同温度时,P1对应的CO的转化率降低,则P1为0.1MPa,故答案为:0.1;
③100℃时,CO的转化率为0.5,则
CO+2H2 CH3OH,
CH3OH,
开始 a 3a 0
转化0.5a a 0.5a
平衡0.5a 2a 0.5a
则K=
=
,
与CH3OH(g) CO(g)+2H2(g)互为逆反应,
CO(g)+2H2(g)互为逆反应,
则化学平衡常数互为倒数,即100℃时,CH3OH(g) CO(g)+2H2(g)反应的平衡常数为为
CO(g)+2H2(g)反应的平衡常数为为
,
故答案为:
;
(3)由甲醇的质子交换膜型燃料电池模型图可知,负极甲醇参与反应,正极氧气参与反应,且H+能通过交换膜,
则正极反应式为3O2+12e-+12H+→6H2O,负极反应式为2CH4O-12e-+2H2O→12H++2CO2,
故答案为:3O2+12e-+12H+→6H2O;2CH4O-12e-+2H2O→12H++2CO2.
 CH3OH(g)△H1=-116kJ?mol-1,
CH3OH(g)△H1=-116kJ?mol-1,②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
根据盖斯定律可知,②+③×2-①可得CH3OH(g)+
| 3 |
| 2 |
则△H=(-283kJ?mol-1)+(-242kJ?mol-1)×2-(-116kJ?mol-1)=-651kJ?mol-1,
即1mol甲醇燃烧生成CO2和水蒸气放出651kJ的热量,故答案为:651;
(2)①对于CO+2H2
 CH3OH,为放热反应,
CH3OH,为放热反应,A.升高温度,化学平衡逆向移动,则甲醇的产率降低,故A错误;
B.将CH3OH(g)从体系中分离,能使反应正向移动,甲醇的产率增大,故B正确;
C.充入He,使体系总压强增大,容积不变,则反应体系中各物质的浓度不变,化学平衡不移动,产率不变,故C错误;
D.再充入1molCO和3molH2,反应物的浓度增大,反应正向移动,甲醇的产率增大,故D正确;
故答案为:BD;
②A.因图中横坐标为温度,纵坐标为CO的转化率,P1、P2为两种不同的压强,则实验中n(CO)/n(H2)相同,即b=1/3,为便于比较,则实验1和实验2的温度应相同,压强不同,即a=150,故答案为;150;1/3;
B.由图可知,相同温度时,P1对应的CO的转化率降低,则P1为0.1MPa,故答案为:0.1;
③100℃时,CO的转化率为0.5,则
CO+2H2
 CH3OH,
CH3OH,开始 a 3a 0
转化0.5a a 0.5a
平衡0.5a 2a 0.5a
则K=
| ||||
|
| V2 |
| 4a2 |
与CH3OH(g)
 CO(g)+2H2(g)互为逆反应,
CO(g)+2H2(g)互为逆反应,则化学平衡常数互为倒数,即100℃时,CH3OH(g)
 CO(g)+2H2(g)反应的平衡常数为为
CO(g)+2H2(g)反应的平衡常数为为| 4a2 |
| V2 |
故答案为:
| 4a2 |
| V2 |
(3)由甲醇的质子交换膜型燃料电池模型图可知,负极甲醇参与反应,正极氧气参与反应,且H+能通过交换膜,
则正极反应式为3O2+12e-+12H+→6H2O,负极反应式为2CH4O-12e-+2H2O→12H++2CO2,
故答案为:3O2+12e-+12H+→6H2O;2CH4O-12e-+2H2O→12H++2CO2.
点评:本题综合性较强,难度较大,注重了对化学反应与能量、化学平衡及平衡计算、电化学等高考考点的考查,对学生能力的要求较高,(2)是学生解答的易错点,体现学生分析问题、解答问题的能力.

练习册系列答案
相关题目
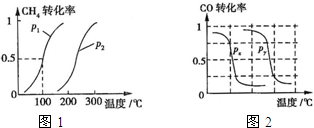 (2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.
(2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇. 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
 ⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
 CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
