题目内容
11.下表是周期表中的一部分,根据A-M周期表中的位置,回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne.
(2)表中元素的最高价氧化物的水化物中:
①碱性最强的化合物的电子式为:
 ,属离子化合物(填“离子”或“共价”);
,属离子化合物(填“离子”或“共价”);②酸性最强的化合物的名称是高氯酸;
③呈两性的化合物的化学式是Al(OH)3.
(3)写出C的最高价氧化物对应水化物和C的氢化物反应的化学方程式:NH3+HNO3=NH4NO3
(4)写出H的最高价氧化物对应水化物和M的氢化物的水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
分析 由元素在周期表中的位置可知,A为H、B为C、C为N、D为O、E为F、F为Ne、G为Na、H为Mg、I为Al、J为Si、K为P、L为S、M为Cl元素,
(1)稀有气体最外层为稳定结构,化学性质最不活泼;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,上述元素的最高价氧化物的水化物中,碱性最强的是NaOH,酸性最强的是高氯酸,氢氧化铝属于两性氢氧化物;
(3)氨气与硝酸反应生成硝酸铵;
(4)氢氧化镁与盐酸反应生成氯化镁与水.
解答 解:由元素在周期表中的位置可知,A为H、B为C、C为N、D为O、E为F、F为Ne、G为Na、H为Mg、I为Al、J为Si、K为P、L为S、M为Cl元素,
(1)以上元素中,只有Ne的最外层电子为8,为稳定结构,则化学性质不活泼,
故答案为:Ne;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强,所以上述元素的最高价氧化物的水化物中碱性最强的是NaOH,电子式为: ,属于离子化合物;
,属于离子化合物;
元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,所以酸性最强的是高氯酸,Al(OH)3具有两性,
故答案为: ;离子;高氯酸;Al(OH)3;
;离子;高氯酸;Al(OH)3;
(3)氨气与硝酸反应生成硝酸铵,反应方程式为:NH3+HNO3=NH4NO3,
故答案为:NH3+HNO3=NH4NO3;
(4)氢氧化镁与盐酸反应生成氯化镁与水,反应离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O.
点评 本题考查元素周期表、元素周期律、常用化学用语等,比较基础,注意对元素周期表结构及物质性质的掌握,有利于基础知识的巩固.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 共价键都具有方向性 | |
| B. | σ键是镜像对称,而π键是轴对称 | |
| C. | π键是由两个p电子“肩并肩”重叠形成的 | |
| D. | σ键 都是由两个p轨道“头碰头”重叠形成的 |
19.下列混合物能用分液法分离的是( )
| A. | 乙醇与乙酸 | B. | 苯和硝基苯 | ||
| C. | 乙酸乙酯和Na2CO3溶液 | D. | 乙醛与水 |
3.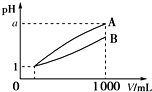 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A. | 若a=4,则A是强酸,B是弱酸 | |
| B. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| C. | A、B两种酸溶液的物质的量浓度一定不相等 | |
| D. | 若1<a<4,则A、B都是弱酸 |
4.镁条在空气中燃烧后,其生成物中可能含有的物质是( )
| A. | MgCO3、MgO、Mg3N2 | B. | Mg(OH)2、MgO、MgCO3 | C. | MgO、Mg3N2、C | D. | Mg3N2、C、MgCO3 |
 .
.


