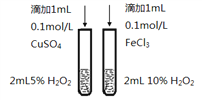
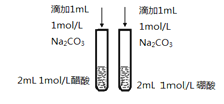
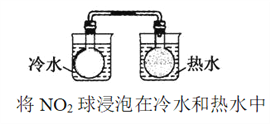
题目内容
【题目】将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后,溶液里各种离子物质的量浓度的关系是 ( )
A.c (OH-) = c(NH4+) + c (H+)B.c (Cl-)> c(NH4+)> c (H+) > c (OH-)
C.c(NH4+) > c (Cl-)> c (OH-)> c (H+)D.c (Cl-)> c (H+) > c (NH4+) > c (OH-)
【答案】C
【解析】
将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后,所得溶液中c(NH3H2O)=c(NH4Cl),此时NH3·H2O![]() NH
NH![]() + OH-,H2O
+ OH-,H2O![]() H++OH-。
H++OH-。
A. 依据电荷守恒c (OH-)+ c (Cl-) = c(NH4+) + c (H+),A错误;
B. 溶液中以NH3·H2O的电离为主,所以c(Cl-)<c(NH4+),c(H+)<c(OH-),B错误;
C. 因为NH3·H2O的电离是少量的,所以c(Cl-)>c(OH-),结合B选项的分析,可得出c(NH4+)>c(Cl-)>c(OH-)>c(H+),C正确;
D. c(H+)只来自水的微弱电离,所以 c(H+)<c(NH4+),D错误。
故选C。

【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。