题目内容
在25℃时, 0.1mol·L-1的HX溶液中,c (OH-)/c (H+) =1×10—6,在该条件下对0.1mol·L-1的HX溶液,下列说法中正确的是
A . HX的电离方程式为:HX=H+ + X—
B 此溶液的pH=1
C.该溶液中c(HX)> c (H+)> c (X-)>c (OH-)
D.与PH=10的NaOH溶液等体积混合溶液呈中性
A . HX的电离方程式为:HX=H+ + X—
B 此溶液的pH=1
C.该溶液中c(HX)> c (H+)> c (X-)>c (OH-)
D.与PH=10的NaOH溶液等体积混合溶液呈中性
C
c (OH-)/c (H+) =1×10—6,10-14/10-6=c(H+)2,得c (H+) =1×10—4 mol·L-1,HX为弱酸。
A .不正确,HX是弱电解质,它的电离方程式为:HX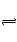 H+ + X—
H+ + X—
B 不正确,c (H+) =1×10—4 mol·L-1,此溶液的pH=4
C.正确,该溶液中c(HX)> c (H+)> c (X-)>c (OH-)
D.不正确,与PH=10的NaOH溶液等体积混合溶液呈酸性,酸浓度大,NaOH不足。
选C。
A .不正确,HX是弱电解质,它的电离方程式为:HX
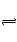 H+ + X—
H+ + X—B 不正确,c (H+) =1×10—4 mol·L-1,此溶液的pH=4
C.正确,该溶液中c(HX)> c (H+)> c (X-)>c (OH-)
D.不正确,与PH=10的NaOH溶液等体积混合溶液呈酸性,酸浓度大,NaOH不足。
选C。

练习册系列答案
相关题目

 B. H2O2 C. Cl2水 D. HNO3
B. H2O2 C. Cl2水 D. HNO3  ___,
___, 通过计算确定上述方案________(填“可行”或“不可行”)。
通过计算确定上述方案________(填“可行”或“不可行”)。