题目内容
【题目】(一)硫是一种重要的非金属元素,在自然界中以游离态和多种化合态形式存在。其中二氧化硫是主要的大气污染物之一。完成下列填空:
⑴火法炼铜中有如下反应:
Ⅰ:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH =-768.2 kJ·mol—1
Ⅱ:2Cu2O(s)+ Cu2S(s)=6Cu(s)+SO2(g) ΔH = +116.0 kJ·mol—1
①在反应Ⅱ中,只作氧化剂的是_________________(用化学式表示)。
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的ΔH=______________________。
⑵工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,配平下列反应式:
______Mn2++______S2O82-+_____H2O = ______MnO4-+______SO42-+_____H+
⑶将SO2通入氯酸溶液中生成一种强酸和一种氧化物,已知反应掉1.5mol氯酸时转移了9.03×1023个电子,写出该反应的化学方程式_______________________________。
(二)为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
⑴已知2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-476.5kJ·mol-1;
将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①CO在0-9min内的平均反应速率v(CO)=_______mol·L-1·min-1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
⑵通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol·L-1的HCOONa溶液pH=10,则HCOOH的电离常数Ka=______________。
【答案】 Cu2O -217.4 kJ·mol—1 2 5 8 2 10 16 SO2+2HClO3=H2SO4+2ClO2 4.4×l0-3 D 22.2% 3.4 1.0×l0-7
【解析】(一)(1)①考查氧化还原反应中的概念,根据反应方程式II,Cu2O中只有Cu的化合价由-1价→0价,化合价降低,Cu2O只作氧化剂,Cu2S中Cu+1价→0价,化合价降低,作氧化剂,S的化合价由-2价→+4价,化合价升高,作还原剂,因此Cu2S既是氧化剂又是还原剂;②考查热化学反应方程式的计算,(I+II)/3得出△H=(-768.2+116)/3kJ·mol-1=-217.4kJ·mol-1;(2)考查氧化还原反应方程式的配平,S2O82-中S显+6价,S2O82-中一个过氧键,因此S2O82-化合价降低2价,Mn2+的化合价升高5价,最小公倍数为10,即Mn2+的系数为2,S2O82-的系数为5,然后根据电荷守恒和原子守恒,配平其他,即2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+;(3)考查转移电子数目的计算,根据信息,利用HClO3的氧化性,把SO2氧化成SO42-,令氯酸的还原产物中Cl的化合价为x价,因此有1.5×(5-x)=9.03×1023/(6.02×1023),解得x=4,即氧化物是ClO2,因此反应方程式为O2+2HClO3=H2SO4+2ClO2;(二)(1)考查化学反应速率的计算、影响化学平衡移动的因素以及化学平衡计算,①根据化学反应速率的数学表达式,v(CO)=(0.1-0.06)/9mol/(L·min)=4.4×10-3 mol/(L·min);A、根据图像,12min平衡向正反应反应方向移动,因为正反应方向是放热反应,升高温度,平衡向逆反应方向移动,故A错误;B、增加NO的量,NO的浓度应增大,但12min时,NO的浓度仍从原平衡开始,故B错误;C、催化剂对化学平衡无影响,故C错误;D、正反应方向是放热反应,降低温度,平衡向正反应方向移动,故D正确;②2NO(g)+2CO(g)=N2(g)+2CO2(g)
起始浓度:0.2 0.1 0 0
变化浓度:0.06 0.06 0.03 0.06
平衡浓度:0.14 0.04 0.03 0.06 因此CO2的体积分数为0.06/(0.14+0.04+0.03+0.06)×100%=22.2%,根据化学平衡常数的定义,K=[c2(CO2)×c(N2)]/×c(N2)]/[c2(NO)×c2(CO)]=(0.062×0.03)/(0.042×0.142)≈3.4;(2)本题考查三大平衡常数的关系,甲酸钠溶液中c(OH-)=Kw/c(H+)=10-14/10-10mol·L-1=10-4mol·L-1,HCOONa水解平衡常数为Kh=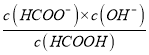 =
=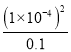 =10-7,三大平衡常数的关系是Kh×Ka=Kw,因此甲酸的电离平衡数Ka=Kw/Kh=10-7。
=10-7,三大平衡常数的关系是Kh×Ka=Kw,因此甲酸的电离平衡数Ka=Kw/Kh=10-7。

【题目】已知下列元素的原子半径:根据以下数据,磷原子的半径可能是
原子 | N | S | O | Si |
半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10m B.1.10×10-10m C.1.20×10-10m D.0.70×10-10m



