题目内容
【题目】在室温下,向100mL CuSO4饱和溶液中加入足量的经硫酸酸化的KI溶液,发生如下反应:2Cu2++4I-=2CuI↓+I2,反应完全后,用0.625mol/L的Na2S2O3溶液进行滴定,I2+2S2O32-=2I-+S4O62-,消耗了20 mL Na2S2O3溶液,计算:
(1)原饱和溶液中CuSO4的物质的量浓度;
(2)若CuSO4饱和溶液的密度为1.0 g/cm3,室温时CuSO4的溶解度是多少。
【答案】(1)0.125 mol/L;(2)2.04克
【解析】试题分析:(1)由离子方程式可得关系式2CuSO4~I2~2S2O32-计算原溶液中CuSO4的物质的量,再根据c=![]() 计算原饱和溶液中CuSO4的物质的量浓度;
计算原饱和溶液中CuSO4的物质的量浓度;
(2)利用c=![]() 计算CuSO4饱和溶液的质量分数,再利用w=
计算CuSO4饱和溶液的质量分数,再利用w=![]() 计算溶解度。
计算溶解度。
解析:(1)设硫酸铜的物质的量难度为x,
根据反应方程式可得关系式:
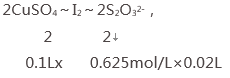
2×0.1Lx=2×0.625mol/L×0.02L
x=0.125 mol/L,
(2)由c=![]() 可知,饱和硫酸铜溶液的质量分数为:w=
可知,饱和硫酸铜溶液的质量分数为:w=![]()
=![]() ,即
,即![]() =0.02,解得S≈2.04g。
=0.02,解得S≈2.04g。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
