题目内容
【题目】下列物质分离提纯所用原理不同于其它的是( )
A.粗盐提纯过滤泥沙B.用四氯化碳萃取碘水
C.实验室乙酸乙酯提纯D.实验室分离苯和溴苯
【答案】C
【解析】
A.粗盐提纯过滤泥沙,利用的是泥沙不溶于水、氯化钠溶于水将它们分离;
B.用四氯化碳萃取碘水,利用的是碘单质在四氯化碳中的溶解度比在水中的溶解度更大而将其与水分离;
C.实验室乙酸乙酯提纯,利用的是乙酸可与碳酸钠反应和乙醇可溶于水的性质而将它们分离;
D.实验室分离苯和溴苯,利用两者的沸点不同或者两者在水中的溶解度不同而将它们分离;
由此可见,C中有用到化学方法,ABD用到的是物理方法;
答案选C。

【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:

(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式:_________________;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为___________,滴定终点观察到的现象为_______________;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为__________,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会___________(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/LCuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2]=2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)=_____ mol/L;
(4)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②_______________________;③过滤;
④______________________;⑤过滤、洗涤、干燥;⑥900℃煅烧。
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 浓硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
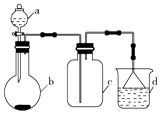
A.A
B.B
C.C
D.D
