��Ŀ����
����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷Ͼɵ�ص�ͭñ(Cu��Zn�ܺ���ԼΪ99%)����Cu���Ʊ�ZnO�IJ���ʵ��������£�

��1��д��ͭñ�ܽ�ʱͭ������ϡ���ᡢ30%H2O2��Ӧ�����ӷ�Ӧ����ʽ��_________________��ͭñ�ܽ���ȫ�������(����)����Һ�й�����H2O2��ȥ��
��2��Ϊȷ������п��(��Ҫ�ɷ�ΪZn��ZnO������Ϊ������������)������ʵ������ⶨ��ȥH2O2����Һ��Cu2���ĺ�����ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2������Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�������ҺpH=3��4�����������KI����Na2S2O3����Һ�ζ����յ㡣���������з�Ӧ�����ӷ���ʽ���£�
2Cu2��+4I��=2CuI(��ɫ)��+I2 2S2O32��+I2=2I��+S4O62��
�ٵζ�ѡ�õ�ָʾ��Ϊ___________���ζ��յ�۲쵽������Ϊ_______________��
��ijͬѧ��ȡ1.0g���ͭñ����ʵ�飬�õ�100.00mL����Cu2������Һ����ȡ20.00mL��������Cu2������Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�������ҺpH=3��4�����������KI����0.1000mol/L Na2S2O3����Һ�ζ����յ㡣���ظ�����ʵ��3�Σ���¼�������£�
ʵ���� | 1 | 2 | 3 | 4 |
V��Na2S2O3��(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
������ͭñ��Cu����������Ϊ__________�������������λ��Ч���֣����ζ�ǰ��Һ�е�H2O2û�г����������ⶨc (Cu2��)����___________(����ƫ��������ƫ����������Ӱ����)��
��3�������£�����50mL 0.0001mol/LCuSO4��Һ�м���50mL0.00022mol/LNaOH��Һ�������˳�������֪KSP[Cu (OH)2]=2.0��10��20(mol/L)3������������ɺ���Һ��c(Cu2+)=_____ mol/L��
��4����֪pH>11ʱZn(OH)2������NaOH��Һ����[Zn(OH)4]2-���±��г��˼������������������������pH(��ʼ������pH����������Ũ��Ϊ1.0 mol��L-1����)��
��ʼ������pH | ������ȫ��pH | |
Fe3�� | 1.1 | 3.2 |
Fe2�� | 5.8 | 8.8 |
Zn2�� | 5.9 | 8.9 |
ʵ���п�ѡ�õ��Լ���30%H2O2��1.0 mol��L-1HNO3��1.0 mol��L-1NaOH���ɳ�ȥͭ����Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��������Һ�м�������30% H2O2��ʹ���ַ�Ӧ��
��_______________________���۹��ˣ�
��______________________���ݹ��ˡ�ϴ�ӡ������900�����ա�
���𰸡� Cu+H2O2+2H+��Cu2++2H2O ������Һ ��ɫ��ȥ 80.99����0.8099 ƫ�� 2��10-10 �μ�1.0 mol��L-1NaOH������ҺpHԼΪ5(��3.2��pH<5.9)��ʹFe3��������ȫ ����Һ�еμ�1. 0 mol��L-1NaOH��������ҺpHԼΪ10(��8. 9��pH��11)��ʹZn2��������ȫ
�������������������1����Ϊ˫��ˮ��������Һ���Ȱ�ͭ����������ͭ����Ȼ����һ�����ķ�Ӧ���γ�һ��ƽ�⣬�����γɵ�����ͭ���Ͼͻᱻϡ�����ܽ⣬ƽ�ⱻ���ƣ���Ӧ����������У��ʶ����ܽ⣬��Ӧ�����ӷ���ʽΪ��Cu+H2O2+2H+=Cu2++2H2O���ʴ�Ϊ��Cu+H2O2+2H+=Cu2++2H2O��
��2����������ҺΪָʾ���������һ��Na2S2O3��Һ����ʱ����Һ��ɫ��ȥ���������ɫ���䣬˵���ζ������յ㣬�ʴ�Ϊ��������Һ����ɫ��ȥ��
�������������ݿ�֪����һ������ƫ��ϴ�ΪżȻ��Ӧȥ��������Na2S2O3����Һ�����Ϊ![]() mL=25��31mL�������ĵ�Na2S2O3�����ʵ���Ϊ0��1000mol/L��0��02531L=0��002531mol�����ݷ�Ӧ2Cu2++4I-�T2CuI����ɫ����+I2��2S2O32-+I2�T2I-+S4O62-�ù�ϵʽ2Cu2+��I2��2S2O32-�����ݹ�ϵ�����ͭԪ�ص�����Ϊ0��002531mol��
mL=25��31mL�������ĵ�Na2S2O3�����ʵ���Ϊ0��1000mol/L��0��02531L=0��002531mol�����ݷ�Ӧ2Cu2++4I-�T2CuI����ɫ����+I2��2S2O32-+I2�T2I-+S4O62-�ù�ϵʽ2Cu2+��I2��2S2O32-�����ݹ�ϵ�����ͭԪ�ص�����Ϊ0��002531mol��![]() ��64g/mol=0��8099g������ͭ����������Ϊ
��64g/mol=0��8099g������ͭ����������Ϊ![]() ��100%=80��99%�����ζ�ǰ��Һ�е�H2O2û�г��������������Ӻ�˫��ˮ���������Ӳ����ĵⵥ�ʣ��ᵼ��Na2S2O3����Һ����ƫ�������ⶨc ��Cu2+������ƫ�ʴ�Ϊ��80��99%��ƫ�ߣ�
��100%=80��99%�����ζ�ǰ��Һ�е�H2O2û�г��������������Ӻ�˫��ˮ���������Ӳ����ĵⵥ�ʣ��ᵼ��Na2S2O3����Һ����ƫ�������ⶨc ��Cu2+������ƫ�ʴ�Ϊ��80��99%��ƫ�ߣ�
��3�������£�����50mL 0��0001mol/L CuSO4��Һ�м���50mL0��00022mol/LNaOH��Һ������������ͭ��������Һ��ʣ����������Ƶ����ʵ���Ũ��Ϊ![]() =0��00001mol/L������c��Cu2+��=
=0��00001mol/L������c��Cu2+��=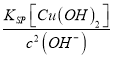 =
=![]() mol/L=2��10-10mol/L���ʴ�Ϊ��2��10-10��
mol/L=2��10-10mol/L���ʴ�Ϊ��2��10-10��
��4���ɳ�ȥͭ����Һ�Ʊ�ZnO ��ʵ�鲽������Ϊ���٢�����Һ�м���30%H2O2��ʹ���ַ�Ӧ��Ŀ��ʹFe2+ת����ȫΪFe3+�����μ�NaOH��Һ��������ҺPHԼΪ5����3��2��pH��5��9����ʹFe3+������ȫ�������ˣ�������Һ�еμ�1��0molL-1NaOH��������ҺPHԼΪ10����8��9��pH��11����ʹZn2+������ȫ�������ˡ�ϴ�ӡ������900�����գ��Ƶ�����п���ʴ�Ϊ�����μ�1��0molL-1NaOH��������ҺPHԼΪ5����3��2��pH��5��9����ʹFe3+������ȫ��������Һ�еμ�1��0molL-1NaOH��������ҺPHԼΪ10����8��9��pH��11����ʹZn2+������ȫ��

 ����˼ά����ѵ����ʱ��ѧ��ϵ�д�
����˼ά����ѵ����ʱ��ѧ��ϵ�д�