题目内容
14.某研究小组利用手持技术,获得2.50g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图1所示.请问答下列问题:(1)试确定113~258℃时固体b的化学式:CuSO4•H2O.
(2)请预测固体c在680~1000℃时的分解产物,下列预测肯定不合理的是C.
A.CuO、SO3
B.CuO、SO2、O2
C.CuO、SO3、O2
D.CuO、SO2、SO3、O2
(3)某兴趣小组用如图2所示装置设计实验,验证(2)中生成的气态物质.
实验现象:装置B中溶液颜色褪去,装置D中产生白色沉淀,将带火星的木条放在气体的出口处有复燃的现象.
①试剂X是:品红溶液或溴水或酸性KMnO4溶液.
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→a b d e f(g).
③某同学认为并不能根据装置D中的现象,认为一定有SO3生成.其理由是因为分解有O2和SO2生成,在水溶液中发生反应:2SO2+O2+2H2O=2H2SO4,故无论分解反应是否有SO3生成,都会有此现象,
2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl(用必要的文字或化学方程式解释)
④该实验方案是否有缺陷?有(填有或无)若有缺陷请你提出解决的办法:装置A和装置D之间应该增加一个防倒吸的装置(若无,则不必回答).

分析 (1)CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解,113~258℃时失去的水的质量为2.50g-1.78g=0.72g,根据反应的化学方程式计算失去水n值;
(2)A、生成CuO、SO3,为非氧化还原反应,预测合理;
B、生成CuO、SO2、O2,氧元素化合价升高,生成O2,S元素化合价降低,符合氧化还原反应原理,预测合理;
C、生成CuO、SO3、O2,氧元素化合价降低,无元素化合价升高,不符合氧化还原反应原理,预测不合理;
D、既有元素化合价升高,也有元素化合价降低,预测合理;
(3)①剩余的二氧化硫污染空气需要吸收;
②依据分解产物中的气体为二氧化硫和三氧化硫,三氧化硫沸点较低冷却后变为液体,二氧化硫可以利用其还原性、漂白性选择试剂验证;
③因为分解有O2和SO2生成,在水溶液中发生反应:2SO2+O2+2H2O=2H2SO4,在氯化钡溶液中生成沉淀不一定是分解生成的三氧化硫;
④装置A和D连接生成气体二氧化硫易溶于水,装置中容易造成液体倒吸.
解答 解:(1)CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解,113~258℃时失去的水的质量为2.50g-1.78g=0.72g,根据反应的化学方程式可知:
CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(5-n)H2O+nH2O
250 18n
2.50g 2.50g-1.78g=0.72g,
解的n=4
113~258℃时固体b的化学式为CuSO4•H2O;
故答案为:CuSO4•H2O;
(2)A、CuSO4•5H2O受热生成CuO、SO3,为非氧化还原反应,预测合理,故A不符合;
B、CuSO4•5H2O受热生成CuO、SO2、O2,氧元素化合价升高,生成O2,S元素化合价降低,符合氧化还原反应原理,预测合理,故B不符合;
C、CuSO4•5H2O受热生成CuO、SO3、O2,氧元素化合价降低,无元素化合价升高,不符合氧化还原反应原理,预测不合理,故C符合;
D、CuSO4•5H2O受热分解,生成CuO、SO2、SO3、O2,既有元素化合价升高,也有元素化合价降低,预测合理,故D不符合.
故答案为:C;
(3)①试剂X的名称可以是利用二氧化硫的漂白性选择品红溶液验证,也可以选择溴水或高锰酸钾溶液利用氧化性氧化二氧化硫反应褪色验证;
故答案为:品红溶液或溴水或酸性KMnO4溶液;
②中生成的气态物质为二氧化硫和三氧化硫气体,三氧化硫沸点较低冷却后变为液体,二氧化硫可以利用其还原性、漂白性选择试剂验证,剩余的二氧化硫污染空气需要吸收;装置连接顺序为:a b d e f(g),
故答案为:a b d e f(g);
③晶体分解过程中,因为分解有O2和SO2生成,在水溶液中发生反应:2SO2+O2+2H2O=2H2SO4,故无论分解反应是否有SO3生成,都会有此现象,2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl,不能根据装置D中的现象,认为一定有SO3生成,
故答案为:因为分解有O2和SO2生成,在水溶液中发生反应:2SO2+O2+2H2O=2H2SO4,故无论分解反应是否有SO3生成,都会有此现象,2SO2+O2+2H2O+2BaCl2=2BaSO4↓+4HCl;
④装置A和D连接生成气体二氧化硫易溶于水,装置中容易造成液体倒吸,该实验方案有缺陷,所以在装置A和装置D之间应该增加一个防倒吸的装置,
故答案为:有;装置A和装置D之间应该增加一个防倒吸的装置.
点评 本题考查了图象分析计算,实验验证的装置连接原理,二氧化硫性质的应用,注意实验过程分析判断,掌握物质性质和数据分析是解题关键,题目难度较大.

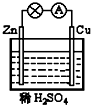
| A. | 正极反应为 Cu-2e-Cu2+ | B. | 溶液中H+向锌片移动 | ||
| C. | 电子由锌片通过导线流向铜 | D. | 该装置能将电能转化为化学能 |
| A. | H2XO3 | B. | H2YO4 | C. | HZO4 | D. | H3RO4 |
| A. | 反应现象相同,反应类型相同 | B. | 反应现象相同,反应类型不同 | ||
| C. | 反应现象不同,反应类型相同 | D. | 反应现象不同,反应类型不同 |
| A. | 1.5mol | B. | 3mol | C. | 4.5mol | D. | 6mol |
 在一体积为10L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O浓度变化如图所示:
在一体积为10L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O浓度变化如图所示:
 为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题: